目次
染色体微小欠失・微小重複|ゲノム疾患(genomic disorder)とコピーナンバーバリアントCNV
ゲノム疾患の概要
ゲノム疾患(ゲノム病)とは、染色体/DNA物質(コピー数変動CNV)の消失・減少または増加に起因する疾患をいいます。
多くの明確に定義されたゲノム障害があり、コピー数の喪失(微小欠失症候群)に起因するものとコピー数の増加(微小重複症候群)に起因するものの2つのカテゴリーに分けることができます。
コピーナンバー変異構造的遺伝的変異 COPY NUMBER VARIATIONS Structural genetic variation
コピーナンバー変異構造的遺伝的変異は典型的には1000塩基対(DNAの1キロ塩基 1kb)以上に及ぶ配列変化の一群をさすとして2006年に報告されたまだまだ新しい概念です。それ以降の研究により、これらの遺伝的変異は例えば400塩基といったもっと小さいものである可能性があり、ほとんどの個体が少なくとも1,000以上のCNVを持っていることが示されています。
これらの配列変異には、コピー数変異(CNV)のような定量的変異、配列再配列(免疫グロブリンの間で観察されるようなもの)、およびゲノムの内容を変化させたり、変化させなかったり、場合によっては疾患を引き起こす染色体再配列を含む他のあまり一般的ではない変異が含まれます。
構造的変異の中で最も一般的なタイプであるCNVは、数千から数百万塩基に及ぶDNAセグメントであり、そのコピー数は個人差があります。
コピー数の増加は、重複、三重化、あるいは複数のコピー数の増加の結果である場合もあります。ほとんどの欠失は、1つの遺伝子座でのコピー数の損失(ヘテロ接合性欠失Loss of Heterozygosity)の結果ですが、場合によっては、この損失が両方の遺伝子座でのコピーに影響を与えることもあります(ホモ接合性欠失)。
CNVは最も一般的には遺伝するのですが、de novo(新生突然変異)として発生することもあります。当初、CNVは散発的な突然変異に起因するまれな事象であり、特定のメンデル病と相関があると考えられていました。
しかし、大規模コホートでのゲノムワイドな評価が時代とともに技術革新に支えられて進むと、これらの事象の希少性や疾患との絶対的な関連性が誤解だったことがわかりました。ヒトゲノムにおけるCNVの違いはだいたは5%くらいだと考えられています。ほとんどの個人が平均3つの大規模なCNVを持っていると考えられています。疾患の発症に寄与する既知のCNVの数は年々ふえ続けています。
コピーナンバーバリアントCNVのできるメカニズムとは
CNVの物理的な分布はゲノム全体で非ランダムであるように見える一方で、CNVのホットスポット(頻発している部位)とコールドスポット(ほとんど見られない部位)の両方が報告されています。CNVの頻度は、セグメント重複領域(CNVが4~10倍に増えている)で最大であり、CNVの主要なメカニズムが非対立遺伝子相同組換えであることとの証左となっています。
コピーナンバーバリアントCNVが正常で認められる場合
CNVは、遺伝子が豊富な領域でより一般的に観察される。CNVは、免疫および炎症反応遺伝子、細胞シグナル伝達および細胞接着分子、構造タンパク質、および嗅覚受容体を含む特定の遺伝子ファミリーに富むようです。これらのほとんどは、おそらく良性のCNVであり、明らかな臨床的影響を伴わない正常な変異を反映していると考えられる 。
コピーナンバーバリアントCNVが病原性(病気を引き起こす性質)を持つ場合
コピーナンバーバリアントCNVに量感受性遺伝子が関与している場合、または調節エレメントを介してゲノム領域に影響を及ぼす場合
CNVは、量感受性遺伝子が関与している場合、または調節エレメントを介してゲノム領域に影響を及ぼす場合には、病原性を示す可能性があります。病原性CNVの中には、一貫した表現型の特徴を持つ症候群性障害を引き起こすものがあります。たとえば、ウィリアムズ症候群におけるエラスチン遺伝子の欠失、シャルコー・マリー・トゥース病1A型(CMT1A)におけるPMP22遺伝子の重複などがこれに当たります。
CNVが病気に対するかかりやすさ、かかりにくさに関連する場合
他方、たとえば、癌、HIV感染症、自己免疫疾患、自閉症などの疾患感受性(疾患に対するかかりやすさ)または疾患抵抗性(疾患に対するかかりにくさ)に関連するものもあります。
コピーナンバーバリアントCNVがメンデル遺伝病の原因となる場合
CNVは、遺伝物質の大きな増加および損失、またはエクソンレベルでの小さな損失または増加または損失に関連するメンデル遺伝病の原因となり得ます。
例としては、以下があります。
1.ウィリアムズ-ベーレン症候群、22q11欠失症候群、スミス-マジェニス症候群、ポトッキ-ルプスキー症候群に見られるような隣接遺伝子の欠失または重複。これらの再発性CNVは、低コピーリピート部位LCRで発生するnononallelic homologous recombination(NAHR)によって媒介されます。
2.常染色体優性(たとえばルビンシュタイン・タイビ症候群)およびXリンク劣性(たとえばデュシェンヌ型筋ジストロフィー)を含むメンデル遺伝病につながる遺伝子または遺伝子の一部(エクソン)の欠失。
コピーナンバーバリアントCNVが遺伝的因子と環境因子の組み合わせでより複雑な症候群と関連するもの
コピーナンバーバリアントCNVはまた、遺伝的因子と環境因子の組み合わせでおこる、より複雑な症候群と関連することがあります。
例えば、自己免疫性炎症性疾患に関連する多くの疾患が挙げられます。これらのCNVのいくつかと疾患との関連性は他の研究でも再現されていますが、必ずしも有意であるとは限らず、研究した集団に依存している可能性があります。
全身性エリテマトーデスのリスクを補体コンポーネント4(C4)遺伝子座の欠失が1.6~5.3倍に高めることが知られています。FCGR3BのA欠失は多発性血管炎を伴う肉芽腫症と関連しています。デフェンシン-β4(DEFB4)の欠失は大腸クローン病のリスク増加と関連しています。また、IRGM遺伝子の上流20kbの欠失もクローン病や乾癬と関連していることが報告されています。エンベロープ蛋白質をコードする2つの遺伝子(LCE3BとLCE3C)の32kb欠失が乾癬の感受性因子(病気になりやすくする因子)として関連しています。
複雑な障害の別の例として、自閉症スペクトラム障害(ASD)や統合失調症患者におけるde novo germ-line CNVの頻度の増加があります。自閉症の発症に関与する可能性のあるヒトゲノムの複数の領域のCNVが現在までに報告されていますし、例えば、15q11-q13領域の重複、16p11.2の欠失および重複、1q21の重複などの特定の遺伝子と自閉症スペクトラム障害ASDおよび関連する症候群との関連も確かめられています。
さらに、いくつかの疾患は複数のCNVと関連しています。一例として、あるレトロスペクティブ研究では、アレイ比較ゲノムハイブリダイゼーション(CGH)を用いて、すでに1つの定義済みCNVを有する発達障害児2312人と、発達障害のない児8329人のCNVを評価したところ、発達障害のない対照群と比較して、発達障害者は第2部位CNVの数が増加していることが判明した。このCNVの増加は、障害の原因となる役割(例えば、新しい遺伝子の破壊を引き起こしたり、遺伝子の発現量を変化させたりすること)を果たしているか、あるいはゲノム損傷に対する感受性の間接的なマーカーである可能性がある。
コピーナンバーバリアントCNVのできる原因とは
低コピーリピートLCRは、95%以上の相同性を共有する約10~300キロベースの反復DNA配列(断片的重複)のことをいいます。これらの高度に相同性の高い領域の誤ったペアリングは、減数分裂の間に位置ずれや不均等な組換えを引き起こす可能性があります。
これにより、染色体の重複および欠失が生じ、CNVが生じることがあります。このプロセスは、ゲノム再配列の形成のための最も一般的なメカニズムであるnonarylelic homologous recombination(NAHR)として知られえているものです。
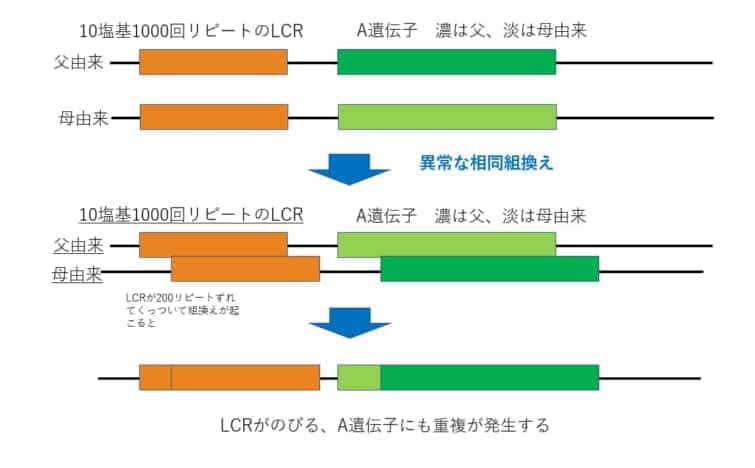
この図はわかりやすく相同組換えの場合を模式化しています。相同ではない部分で組換えをおこすのがNAHRです。
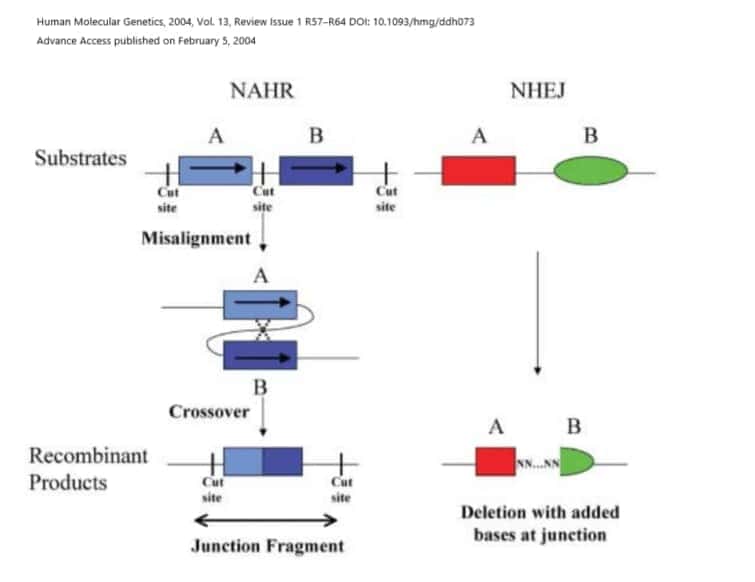
NAHRは、同じメカニズムを介して、低コピーリピートを媒介とする非対立遺伝子間での相同組換えのために、欠失または重複のいずれかをもたらします。古典的な例は、染色体17p11.2上のPMP22遺伝子の重複によって引き起こされる末梢神経障害であるシャルコー・マリー・トゥースI型です。同じ領域が欠失した場合には、圧力に対する感覚が麻痺することを引き起こす遺伝性神経障害(HNPP)としても知られている別の神経障害も生じます。
CNVがどのようにして発生するかについてはいろいろわかってきたにもかかわらず、特定の個体が他の個体よりもこのような変化を発症しやすいのがなぜかということは分かっていません。
興味深いことに、発達障害のある患者を対象とした大規模な研究では、親のデータからCNVが遺伝的なものなのか、それとも生まれつきのものなのかについての情報が得られている。この研究では、CNVはウィリアムズ・ベーレン症候群などの症候性障害では新規に発生する可能性が高いのに対し、CNVは例えば知的障害など表現型(症状)が変わる障害では遺伝する可能性が高いことが示唆されました。これを説明する仮説としては、より重度の症候群性障害を持つ個体では生殖能力が低下しているため重度になればなるほど遺伝性が失われることが考えられます。
コピーナンバーバリアントCNVをどう考えるべきか
CNVをどう解釈すべきかは、一見正常な対照との直接比較を可能にする大規模な対照データベースの使用により、着実に改善されてきました。これらのデータベースの例としては、Database of Genomic Variants (DGV)、1000 Genomes Projectのような大規模なシーケンシングプロジェクト、またはClinVarがあります。その他、DECIPHER(DatabasE of Chromosomal Imbalance and Phenotype in Humans using Ensembl Resources)のような表現型情報を含むデータベースは、アレイ比較ゲノムハイブリダイゼーションによって検出された所見のための貴重なリソースを提供しています。DECIPHERは、世界中の247以上のメンバーセンターが寄託したアレイデータと臨床データを収録したウェブベースのリソースです。英国で行われたDeciphering Developmental Disorders研究では、重度の発達遅延を持つ14,000人の子供とその親をマイクロアレイエンドエクソームシークエンシングで評価しました。これらの大規模研究は、CNVデータを解釈する上で非常に貴重なツールとなっています。
1人の個体に複数のCNVが存在する場合、CNVの病原性を解釈することは非常に困難となります。いくつかの研究では、複数のまれなCNV(遺伝性またはde novo)が臨床的な重症度を悪化させる可能性があることが示されています。一般集団における一般的なCNVの存在を強調することも重要ですが、これらの一般的な多型の多くが、一般的な疾患において役割を果たしているかどうかは不明となっています。
コピーナンバーバリアントCNVの病原性のメカニズム
疾患のメカニズム欠失および重複に続発するゲノム障害において疾患を引き起こす可能性のあるさまざまなメカニズムがあります。
ハプロ不全
主なメカニズムは、量感受性遺伝子の変化に関連しています。「ハプロ不全」(ハプロ=半分)は、遺伝子の1つの対立遺伝子の欠損または増加が異常な量のタンパク産生または機能異常につながり、それによって疾患を引き起こすという概念です。
欠失は、必要とされる遺伝子産物の産生を阻害し、疾患を引き起こす可能性がある。たとえばエラスチン遺伝子を含む複数の遺伝子が関与する7番染色体7q11.23の微小欠失によって引き起こされるウィリアムズ・ボーレン症候群があげられます。エラスチンの正常量の半分しか産生されないと、大動脈の狭窄や他の複数の動脈異常につながる動脈の障害を引き起こしてしまいます。ウィリアムズ・ボーレン症候群における欠失は、他の多くのゲノム障害で起こることと同様に、さまざまな大きさのものがある。典型的には1.55Mbの欠失ですが、場合によっては、より広範な欠失になることもあれば、より小さい欠失になることもあります。サイズの違いは、再配列の媒介に関与しうる臨界領域周辺の異なるLCRによるものです。
重複はまた、遺伝子を破壊し、タンパク合成またはタンパクの会合を妨害することにより、タンパク質の産生量を変化させることがある。
コピーナンバーバリアントCNVが劣性対立遺伝子をアンマスクする
もう一つのメカニズムとしては、劣性対立遺伝子のアンマスクがあります。劣性対立遺伝子が機能不全におちいり、さらにもう一方の染色体上に残っているコピー(遺伝子)が病的バリアントを持っていた場合。これは、通常なら片方正常で疾患を発症しないものが、両方病的になってしまったために正常に機能するコピーが残っていないということで、疾患発症につながります。
コピーナンバーバリアントCNVがインプリンティングのある遺伝子に干渉する
ベクウィット・ヴィーデマン症候群の原因となる11p15の父系重複のような、インプリンティング遺伝子への干渉が該当します。
一塩基多型(SNP)アレイは、片親性ダイソミーに起因するインプリンティング障害の同定を可能にします。アンジェルマン症候群(AS)などの片親性ダイソミー(UPD)で、アイソダイソミーによりおこります。アイソダイソミーは、第2減数分裂における非接合か、接合後の重複(モノソミーレスキュー)のいずれかが原因でできるものです。少数のAS症例はUPDの結果である。これらの症例では、15番染色体のある領域(15q11-q13)の母親の寄与がない。これらの症例は、典型的には、父方の15番染色体の2つの同一のコピーが存在し、母方の寄与がないモノソミーレスキュー(単細胞接合体からの染色体の複製)に関連しています。UPDの他の例としては、Prader-Willi症候群の患者に見られる。(「Prader-Willi症候群の疫学と遺伝学」を参照)。
コピーナンバーバリアントCNVが隣接遺伝子症候群を引き起こす
隣接遺伝子症候群は、大きなCNVが複数の隣接する遺伝子に影響を及ぼすときに起こりうる症候群です。例えば、ウィリアムズ-ベーレン症候群は、染色体7q11上の1.5-1.8Mbの欠失によって引き起こされまするが、これは典型的には9つの遺伝子を包んだ領域です。ウィルムス腫瘍、アニリジア(虹彩のできない先天異常)、生殖器異常、および精神遅滞からなるゲノム疾患であるWAGR症候群では、臨床的特徴は、大きな欠失による個々の遺伝子の喪失に起因しています。たとえば、WT1の欠失はウィルムス腫瘍の原因となり、PAX6の欠失はアニリジアの原因となります。
コピーナンバーバリアントCNVの遺伝学的的異常の検出
コピーナンバーバリアントCNV遺伝学的異常は、通常、アレイ比較ゲノムハイブリダイゼーション(アレイCGH)によって検出されます。ほとんどの検査室では、蛍光in situハイブリダイゼーション(FISH)、多重ライゲーション依存性プローブ増幅(MLPA)、または定量的PCR(Q-PCR)などの独立した方法でアレイ上で検出されたゲインまたはロスを確認しています。多くは遺伝性であり、将来の妊娠に関連するものであるため、検出されたゲノム異常のすべての症例において、親によるFISH検査、および選択された症例ではアレイCGHの実施が保証される。ゲノム上の欠損の位置はアレイからは明らかですが、ゲイン(増加)はタンデム重複か挿入のいずれかです。後者が親の挿入転座(IT)の結果として生じる場合、これは将来の妊娠に重要な意味を持つ可能性があります。エクソームシークエンシングに使用されている次世代シークエンシング(NGS)技術もCNVを同定する可能性があり、CNVと配列変異を同時に検出するためのリソースになるかもしれません。
アレイ比較ゲノムハイブリダイゼーション
アレイ比較ゲノムハイブリダイゼーション(アレイCGH)は、染色体マイクロアレイまたはマイクロアレイベースの比較ゲノムハイブリダイゼーションとしても知られており、ゲノム疾患の原因となるCNVを検出するためのゴールドスタンダードな臨床検査である。アレイCGHでは、数キロ塩基(kb)まで、さらにはエクソンレベルのゲノム物質のわずかなロスやゲインを検出することができます。これは、知的障害や先天性奇形の患者の評価に広く用いられている。現在CNVの検出に使用されている2つの主要なプラットフォームは、オリゴヌクレオチドアレイ(オリゴヌクレオチドとは、25~60塩基対のDNAの伸長体のことを言います)、および一塩基多型アレイ(SNPアレイ)です。ヒトゲノム全体には約1,000万個の多型SNPが存在します。SNPとオリゴヌクレオチドアレイのどちらもコピー数の変動を検出することができますが、SNPアレイはヘテロ接合性の欠如またはホモ接合性の有無の判定に使用できます。SNPはまた、体細胞癌細胞の変化に典型的に見られるヘテロ接合性の喪失(LOH)を検出することもできます。SNPはまた、体細胞モザイク症(単一の個体に2つ以上の細胞株が存在し得る状況)、および三倍体症(出生前の設定で検出され得る合計69本の染色体(3つのハプロイドセット)が存在し得る稀な例)の検出にも非常に有用である。現在のプラットフォームの中には、1つのプラットフォームに統合されたアレイCGHとSNPの使用を組み合わせたものもあります。
コピーナンバーバリアントCNVの検出のためのその他の分子診断技術
ゲノム疾患の検出に使用されるその他の分子検査技術には、蛍光in situハイブリダイゼーション(FISH)、Q-PCR(定量PCR)、MLPA(Multiple Ligation Dependent Probe Amplification)のようなPCRベースの手法があります。全ゲノムまたはエクソーム(タンパク質をコードするゲノムのすべての領域)のシークエンシングを使用するプロトコルは、CNVの変異を検出するための実行可能なオプションになる可能性が高いと考えられます。
FISH
FISHは、特定のゲノム領域を標的とするために、蛍光試薬で標識されたより大きなDNAの伸長(約50~200キロ塩基のプローブ)を使用します。しかし、FISHの使用には、どのような特定の領域を標的としているかの知識が必要であり、臨床診断に依存するのが難点です。つまり、臨床診断があっていなければいくらFISHをやっても結果は陽性には出ません。FISH法では、メタフェース(間期といって細胞が分裂していない時期)の染色体の広がりを可視化すれば、染色体のなかでの位置を特定することができます。コピー数の増加は、関心のある領域に隣接する染色体の重複、マーカー染色体(部分的なトリソミーを構成する構造的に異常な染色体)の一部、または挿入や転座の結果である可能性があります。互いに非常に近い位置にある重複は、メタフェースFISHでは検出が困難な場合があり、間期FISHで検出するのが最適です。
MLPA
MLPAは、キットで入手できる複数のプローブのカクテルを使用し、特定の染色体または疾患領域を標的とします。1回の反応で複数のプローブを複数の領域、あるいは遺伝子内の複数のエクソンに同時にハイブリダイゼーションすることができます。FISHと比較した場合のMLPAの利点は、複数のプローブを使用するため、低コストでコピー数のゲイン/ロス検出の網羅性が高いことです。難点はMLPAでは位置情報は得られないことです。
WES whole exome sequence
ゲノム全体またはエクソームのシークエンシングは、ゲノム疾患の検出にも利用可能です。849人の個体からのシークエンシングを用いてCNVの領域と遺伝子の投与量における役割を同定した研究で実証されました。ゲノムシークエンシングはまた、染色体領域の重複の原因となるゲノム内のブレークポイントをマッピングするためにも使用されています。シーケンシングは分解能を向上させる可能性を持っているが、CNVを検出するためのシーケンシングの感度と特異度にはばらつきがあります。全ゲノムシークエンシング(WGS)は、1塩基変異とコピー数変異の同時検出を可能にするが、検査コストが高すぎるのが難点です。WGSはCNVの検出を正確に達成することができるが、マイクロアレイの使用が引き続きゴールドスタンダードである。
まとめ
ゲノム疾患とは、染色体またはDNAの欠失や増加に起因する疾患です。最も一般的で、より明確に定義されているゲノム疾患(ゲノム病)は、コピー数の喪失(欠失症候群)とコピー数の増加(重複症候群)に起因するものに大きく分けられます。
コピーナンバー・バリエーション(CNV)とは、1 つ以上の DNA のコピー数の違いによるゲノムの微視的な違いのことで、DNA の獲得や損失をもたらすものです。病原性CNVの中には、一貫した表現型の特徴を持つ症候群性疾患を引き起こすものがあります。他のCNVは、疾患の感受性や抵抗性と関連しています。
欠失や重複に続発するゲノム障害で疾患を引き起こす主なメカニズムは、量感受性遺伝子の変化です。その他の疾患メカニズムとしては、インプリンティング遺伝子との干渉や、遺伝子外の調節要素との干渉などがあります。
ゲノム疾患は通常、アレイ比較ゲノムハイブリダイゼーション(アレイCGH)で検出されます。多くの検査室では、蛍光in situハイブリダイゼーション(FISH)、多重ライゲーション依存性プローブ増幅(MLPA)、定量PCR(Q-PCR)などの独立した方法で検出されたゲインやロスを確認しています。次世代シーケンシング(NGS)はCNVを検出するための一般的な方法になる可能性が高いが、マイクロアレイ検査は依然として標準的な検査法であり続けています。
この記事の著者:仲田洋美医師
医籍登録番号 第371210号
日本内科学会 総合内科専門医 第7900号
日本臨床腫瘍学会 がん薬物療法専門医 第1000001号
臨床遺伝専門医制度委員会認定 臨床遺伝専門医 第755号






