目次
この記事では、ATPとリン酸化プロセスの基本的な概念、その細胞内での役割、および生体におけるエネルギー代謝への影響について詳しく解説します。ATPがどのようにしてエネルギーの通貨として機能し、生命活動を支えるかを科学的に掘り下げます。
第1章: ATPとは
ATPの化学的構造と生化学的特性
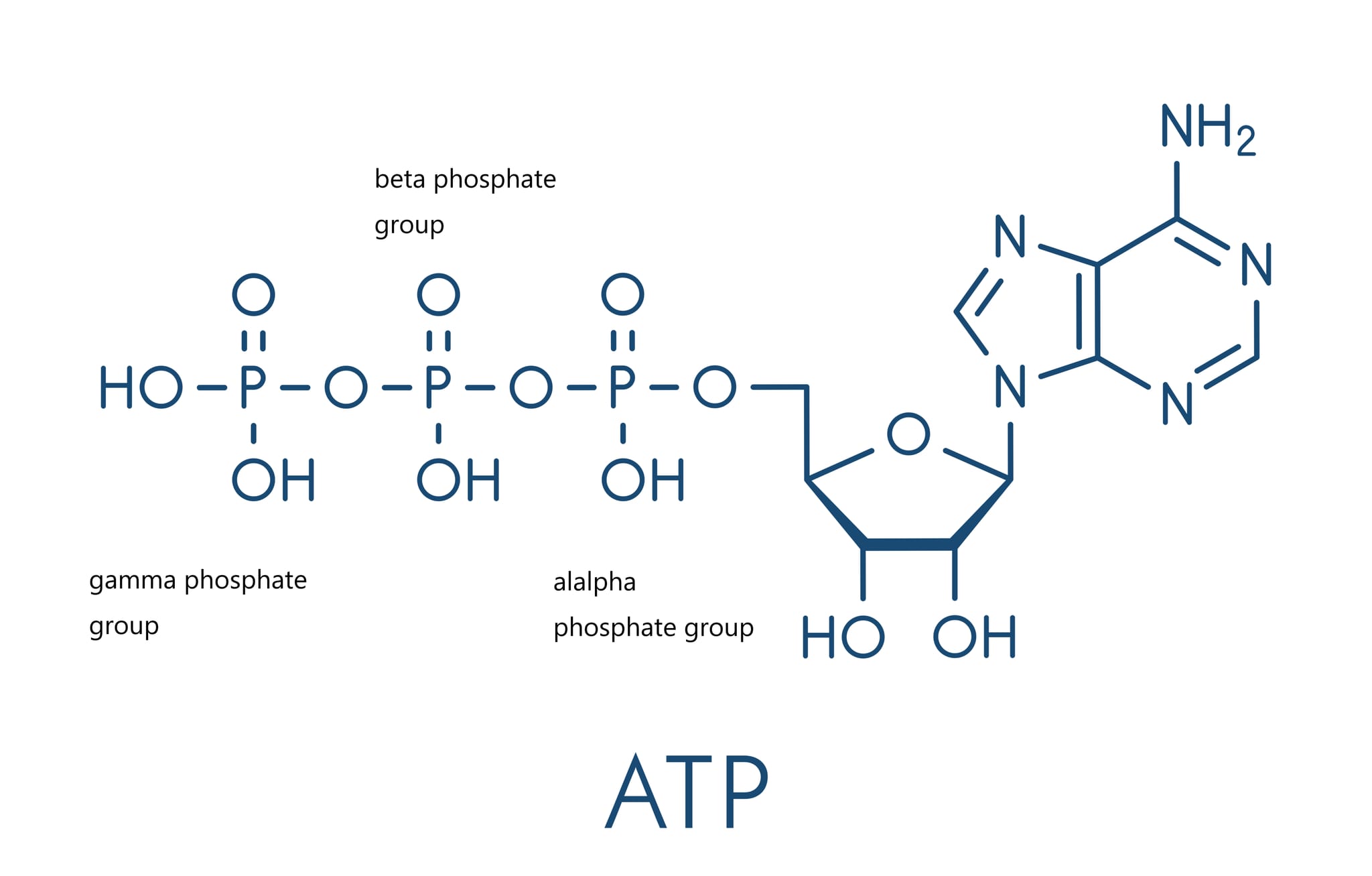
アデノシン三リン酸(ATP)は、アデニン、リボース(糖)、および三つのリン酸基から構成される化合物です。この分子は、生体内でエネルギーを蓄え、輸送し、放出するための主要な手段として機能します。ATPの化学式は C10H16N5O13P3 で、モル質量は507.181 g/molです[12]。
● 化学的構造
ATPの構造は、アデノシン部分(アデニンとリボース)と、それに結合している三つのリン酸基で構成されています。リン酸基は、エステル結合および無機ピロリン酸結合を介して連結されています。特に、二番目と三番目のリン酸基間の結合は、高エネルギーリン酸結合と呼ばれ、ここに大量のエネルギーが蓄えられています[11]。ATP(アデノシン三リン酸)が高エネルギー化合物とされる理由は、その分子構造にあります。ATP分子は、アデノシンというアデニンとリボースから成る部分と、三つのリン酸基が結合しています。特に、リン酸基同士の結合、特に二番目と三番目のリン酸基の間の結合(高エネルギーリン酸結合)は、非常にエネルギーを多く含んでいます。
この高エネルギーリン酸結合が加水分解されるとき、大量のエネルギーが放出されます。具体的には、ATPがADP(アデノシン二リン酸)と無機リン酸に分解される際に、約30キロジュールのエネルギーが遊離されるとされています。このエネルギーの放出は、リン酸基間の反発力と結合の不安定性によるもので、リン酸基が負の電荷を持っているため、互いに反発し合っています。この反発力を克服してリン酸基を結合させるためには、多くのエネルギーが必要であり、そのエネルギーが結合に蓄えられているため、結合が切れるときに大量のエネルギーが放出されるのです。
さらに、ATPの加水分解は生体内で非常に重要な反応であり、この反応によって放出されるエネルギーは、細胞内での多くの生化学的プロセスを推進するために利用されます。例えば、筋肉の収縮、細胞内物質の輸送、生体分子の合成など、生命活動に必要なエネルギーを供給する基本的な源となっています。
このように、ATPが高エネルギー化合物である理由は、その化学的構造と、生体内でのエネルギー変換の中心的役割によるものです。
アルファ(α)、ベータ(β)、ガンマ(γ)リン酸とは、アデノシン三リン酸(ATP)分子に含まれる三つのリン酸基のことを指します。これらのリン酸基は、リボース糖の5’炭素に結合しており、それぞれが異なる位置にあります。リン酸基は、リボースから近い順にα、β、γと命名されています。
αリン酸(アルファリン酸)は、リボースの5’炭素に最も近いリン酸基です。
βリン酸(ベータリン酸)は、αリン酸の次に位置するリン酸基です。
γリン酸(ガンマリン酸)は、ATP分子の最も外側に位置するリン酸基で、最もエネルギーを多く含んでいるとされています。このγリン酸基は、細胞内でのエネルギー転移反応において、加水分解されることでエネルギーを放出します。
ATP分子は、細胞内でのエネルギー通貨として機能し、γリン酸基の加水分解によってエネルギーを放出することで、多くの生化学的プロセスを推進します。このエネルギーは、筋肉の収縮、細胞内物質の輸送、生体分子の合成など、生命活動に必要なプロセスに利用されます。
● 生化学的特性
ATPは、その高エネルギーリン酸結合を加水分解することでエネルギーを放出します。この反応は、ATPをアデノシン二リン酸(ADP)と無機リン酸(Pi)に変換し、生物学的プロセスに必要なエネルギーを提供します[9]。ATPの加水分解は、細胞内で最も重要な化学反応の一つであり、多くの生物学的プロセスを動力付けるために利用されます[7]。
ATPの合成は主にミトコンドリアのATP合成酵素によって行われ、この過程は酸化的リン酸化として知られています。このプロセスは、電子伝達系によって生成されるプロトンの勾配を利用してATPを合成します[8][12]。
ATPは、細胞内外で多様な機能を果たします。細胞外では、ATPはシグナル伝達分子として機能し、特定の受容体に結合することで細胞応答を引き起こします[13]。
● エネルギーの放出と利用
ATPからエネルギーが放出されるとき、通常、最も末端のリン酸基が切り離され、ADPと無機リン酸が生成されます。この反応は約30.5 kJ/molのエネルギーを放出し、このエネルギーは筋収縮や他の多くの細胞プロセスに利用されます[5][9]。
ATPの生化学的特性とそのエネルギー変換の効率は、生命活動を支える基本的なメカニズムとして、生物学および医学の研究において非常に重要です。
- 参考文献・出典
-
[1] www.yokohama-cu.ac.jp/news/2022/20221020Moritsugu.html
[2] www.jstage.jst.go.jp/article/biophys/50/2/50_2_094/_pdf
[3] ocw.nagoya-u.jp/files/421/maeshima_lecture_handout.pdf
[4] www.sci.tohoku.ac.jp/news/20190523-10293.html
[5] www.dnszone.jp/nutrition_guide/1-3/
[6] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2022.940205/data/index.html
[7] www.sc.fukuoka-u.ac.jp/~bc1/Biochem/general.htm
[8] numon.pdbj.org/mom/72?l=ja
[9] www.e-healthnet.mhlw.go.jp/information/dictionary/exercise/ys-008.html
[10] resou.osaka-u.ac.jp/ja/research/2017/20170407_1
[11] www.try-it.jp/chapters-10282/sections-10366/lessons-10371/point-2/
[12] ja.wikipedia.org/wiki/%E3%82%A2%E3%83%87%E3%83%8E%E3%82%B7%E3%83%B3%E4%B8%89%E3%83%AA%E3%83%B3%E9%85%B8
[13] www.jstage.jst.go.jp/article/fpj1944/98/3/98_3_235/_pdf/-char/ja
[14] www.ims.ac.jp/learn/test/2013/1st_seibutu.pdf
ATPの細胞内での役割とその重要性
アデノシン三リン酸(ATP)は、すべての生物細胞において基本的なエネルギー運搬体として機能します。この分子は、細胞の多様な生理的プロセスを支えるエネルギーを提供することで、生命活動の基盤を形成しています。
● ATPの基本的な機能
1. エネルギー供給: ATPは、その高エネルギーリン酸結合を加水分解することでエネルギーを放出します。このエネルギーは、筋収縮、細胞内物質の輸送、生化学的反応の触媒など、生命活動に必要な多くのプロセスに利用されます[4][6].
2. 代謝プロセスの調節: ATPは、酵素の活性化や阻害を通じて、細胞内の代謝経路を調節する役割も担います。例えば、多くの代謝経路では、ATPの濃度が酵素の活性を直接的に制御することが知られています[1][2].
3. シグナル伝達: ATPは細胞外に放出されることで、細胞間コミュニケーションのシグナルとして機能することがあります。特に、炎症反応や神経伝達において重要な役割を果たします[8].
● ATPの特定の生理的役割
– 筋肉の収縮: ATPは筋肉細胞において、アクチンとミオシンの相互作用を促進し、筋収縮を引き起こすために必要です[4][6].
– 細胞死と生存の調節: ATPの濃度は、細胞の生存やアポトーシス(プログラムされた細胞死)に影響を与えることが示されています。特に、アポトーシス中にはATP濃度が低下し、これが死の進行に関与することがあります[1][8].
– 神経変性疾患との関連: ATPの濃度が異常に低下すると、タンパク質の異常な凝集が促進されることがあり、これがアルツハイマー病などの神経変性疾患の発症に関与する可能性があります[2][13][14].
● ATPの生成と再合成
ATPは主にミトコンドリアでの酸化的リン酸化によって生成されますが、解糖系やクレアチンリン酸システムを通じても迅速に再合成されることがあります。これにより、細胞はエネルギー需要が急激に増加する状況(例えば、激しい運動中)に迅速に対応できます[4][12].
ATPのこれらの役割と機能は、細胞の健康と機能の維持に不可欠であり、生物学的プロセスの理解において中心的な位置を占めています。
- 参考文献・出典
-
[1] www.jstage.jst.go.jp/article/biophys/62/2/62_125/_html/-char/ja
[2] www.gunma-u.ac.jp/information/127008
[3] www.jstage.jst.go.jp/article/biophys/53/1/53_020/_pdf
[4] www.dnszone.jp/nutrition_guide/1-3/
[5] home.hiroshima-u.ac.jp/naka/wiki/wiki.cgi
[6] www.e-healthnet.mhlw.go.jp/information/dictionary/exercise/ys-008.html
[7] www.kyoto-su.ac.jp/project/st/st11_06.html
[8] www.cc.kyoto-su.ac.jp/~yokoken/contents/introduction.html
[9] www.brh.co.jp/publication/journal/043/research_11
[10] nitta-monitoring.com/sanitary/atp/adenosine-triphosphate/
[11] www.almediaweb.jp/diabetes_dialysis/diabetes_dialysis-003/part2/02.html
[12] www.e-healthnet.mhlw.go.jp/information/exercise/s-02-001.html
[13] www.kyoto-u.ac.jp/ja/research-news/2022-04-25
[14] www.giar.gunma-u.ac.jp/%E2%BE%BC%E6%BF%83%E5%BA%A6%E3%81%AEatp%E3%81%8C%E3%82%BF%E3%83%B3%E3%83%91%E3%82%AF%E8%B3%AA%E3%81%AE%E7%95%B0%E5%B8%B8%E3%81%AA%E5%87%9D%E9%9B%86%E3%82%92%E9%98%B2%E3%81%90%E3%80%80%E9%AB%98/
第2章: リン酸化プロセスの概要
リン酸化の種類とメカニズム
リン酸化は、タンパク質の機能を調節するための重要な翻訳後修飾の一つです。このプロセスでは、特定のアミノ酸の残基にリン酸基が付加され、タンパク質の活性、安定性、または位置が変化することがあります。リン酸化は、細胞のシグナル伝達、増殖、分化、死などの多くの生物学的プロセスを制御する中心的な役割を果たしています[9][15]。
● リン酸化の種類
リン酸化は主に以下の三つのアミノ酸残基で発生します:
1. セリン(Serine)
2. スレオニン(Threonine)
3. チロシン(Tyrosine)
これらの残基は、側鎖にフリーハイドロキシル基(-OH)を持っており、この部分にリン酸基が結合します。セリンとスレオニンのリン酸化は最も一般的であり、チロシンのリン酸化は細胞の成長や分化に関連するシグナル伝達経路で特に重要です[9][12][15]。
● リン酸化のメカニズム
リン酸化のプロセスは、キナーゼ(カイネース)と呼ばれる酵素によって触媒されます。キナーゼはATP(アデノシン三リン酸)からリン酸基を取り出し、ターゲットとなるタンパク質のアミノ酸残基に転移させます。この反応は、特定のシグナルが細胞に到達したときに起こり、タンパク質の活性を変化させることで、細胞内の応答を引き起こします[9][15]。
逆のプロセスである脱リン酸化は、ホスファターゼと呼ばれる別の酵素群によって行われます。ホスファターゼはリン酸基をタンパク質から除去し、タンパク質をその元の状態に戻します。このようにして、リン酸化と脱リン酸化のバランスが細胞内のプロセスを精密に制御します[9][15]。
● シグナル伝達とリン酸化
リン酸化はシグナル伝達経路の重要な部分であり、細胞外の刺激が細胞内の応答を引き起こすメカニズムにおいて中心的な役割を果たします。例えば、成長因子が受容体に結合すると、その受容体のリン酸化が引き起こされ、これがさらに多くのタンパク質のリン酸化を誘発し、細胞の成長や分裂を促進するシグナルカスケードが活性化されます[9][11][12]。
このように、リン酸化は生物学的プロセスの調節において不可欠であり、その精密な制御は健康と病気の両方において重要な意味を持ちます。
- 参考文献・出典
-
[9] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/phosphorylation.html
[10] www.jstage.jst.go.jp/article/kagakutoseibutsu1962/41/8/41_8_530/_pdf/-char/en
[11] ja.wikipedia.org/wiki/%E8%87%AA%E5%B7%B1%E3%83%AA%E3%83%B3%E9%85%B8%E5%8C%96
[12] yumenavi.info/vue/lecture.html?gnkcd=g001989
[13] monoist.itmedia.co.jp/mn/spv/1602/11/news014.html
[14] ja.wikipedia.org/wiki/%E9%85%B8%E5%8C%96%E7%9A%84%E3%83%AA%E3%83%B3%E9%85%B8%E5%8C%96
[15] www.thermofisher.com/se/en/home/industrial/mass-spectrometry/proteomics-mass-spectrometry/proteomics-mass-spectrometry-workflows/phosphoproteomics.html
リン酸化が細胞機能に及ぼす影響
リン酸化は、生体内で行われる重要な翻訳後修飾の一つであり、タンパク質の機能や活性、局在、相互作用などを調節するために不可欠です。このプロセスは、特定のアミノ酸残基(主にセリン、スレオニン、チロシン)にリン酸基を付加することによって行われます。リン酸化は、キナーゼと呼ばれる酵素によって触媒され、脱リン酸化はホスファターゼによって行われます。これらの酵素の活動により、細胞内のリン酸化タンパク質の動的なバランスが保たれています[16]。
● 睡眠の制御におけるリン酸化
睡眠の制御において、たんぱく質のリン酸化修飾が重要な役割を果たしていることが示されています。特に、CaMKIIβというたんぱく質リン酸化酵素が、睡眠の誘導や維持に関与していることが研究で明らかにされています。この酵素は、自己リン酸化によってその活性が変化し、睡眠の制御に必要な複数の機能を担っている可能性があります[1]。
● 炎症反応におけるリン酸化
炎症反応においても、リン酸化が重要な役割を果たしています。Regnase-1というmRNA分解酵素がインターロイキン17によってリン酸化されることが炎症制御機構において非常に重要であることが発見されました。Regnase-1のリン酸化を阻害することで、強い抗炎症効果が得られる可能性が示唆されています[2]。
● 神経系におけるリン酸化
神経系においては、チロシンリン酸化が神経発生や神経可塑性の過程で重要な役割を果たしています。チロシンリン酸化は、タンパク質の活性や局在、タンパク質間の結合、イオンチャンネルのコンダクタンスと開口確率の制御など、多岐にわたる神経機能に影響を及ぼします[4]。
● がん治療におけるリン酸化
がん治療においても、リン酸化シグナルが重要です。がんの増殖や薬剤感受性を決定するリン酸化酵素の活性を測定する技術が開発され、新たながん治療の開発に応用可能であると考えられています[6]。
● 細胞内非膜型オルガネラの構造形成
リン酸化は、細胞内非膜型オルガネラの構造形成および機能発現で重要な役割を果たす「液-液相分離」を制御する新たな仕組みに関与しています。リン酸化によるタンパク質の立体構造変化が、その機能を調節することが知られていましたが、立体構造を持たないタンパク質の機能を制御するメカニズムも明らかにされています[10]。
これらの研究結果は、リン酸化が細胞の多様な機能に深く関わっており、生命現象の調節において中心的な役割を担っていることを示しています。リン酸化は、細胞の応答、シグナル伝達、代謝調節などにおいて、タンパク質の活性化や不活性化を通じて細胞機能を微妙に調整することにより、生体の恒常性維持に寄与しています。
- 参考文献・出典
-
[1] www.jst.go.jp/pr/announce/20221005-2/pdf/20221005-2.pdf
[2] resou.osaka-u.ac.jp/ja/research/2019/20190522_2
[3] www.tyojyu.or.jp/net/kenkou-tyoju/eiyouso/mineral-p.html
[4] bsd.neuroinf.jp/wiki/%E3%83%81%E3%83%AD%E3%82%B7%E3%83%B3%E3%83%AA%E3%83%B3%E9%85%B8%E5%8C%96
[5] kotobank.jp/word/%E3%83%AA%E3%83%B3%E9%85%B8%E5%8C%96%E5%8F%8D%E5%BF%9C-150344
[6] www.ncc.go.jp/jp/information/pr_release/2019/1226/index.html
[7] sirabe.nirs.qst.go.jp/sirabe/%E3%82%BF%E3%83%B3%E3%83%91%E3%82%AF%E8%B3%AA%E3%83%AA%E3%83%B3%E9%85%B8%E5%8C%96
[8] www.tyojyu.or.jp/net/kenkou-tyoju/rouka/sanka-sutoresu.html
[9] www.ptglab.co.jp/news/blog/tips-for-detecting-phosphoproteins-by-western-blot/
[10] www.amed.go.jp/news/seika/kenkyu/20220527.html
[11] www.msdmanuals.com/ja-jp/professional/19-%E5%B0%8F%E5%85%90%E7%A7%91/%E9%81%BA%E4%BC%9D%E6%80%A7%E4%BB%A3%E8%AC%9D%E7%96%BE%E6%82%A3/%E3%83%9F%E3%83%88%E3%82%B3%E3%83%B3%E3%83%89%E3%83%AA%E3%82%A2%E9%85%B8%E5%8C%96%E7%9A%84%E3%83%AA%E3%83%B3%E9%85%B8%E5%8C%96%E9%9A%9C%E5%AE%B3
[12] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2023.950029/data/index.html
[13] www.tcichemicals.com/JP/ja/c/12670
[14] www.irp.niigata-u.ac.jp/news/230/
[15] www.youtube.com/watch?v=YCPIkA5BG9A
[16] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/phosphorylation.html
第3章: ATPとリン酸化のエネルギー代謝への貢献
エネルギー生成におけるATPの役割
アデノシン三リン酸(ATP)は、生物の細胞内でエネルギーを蓄え、利用するための主要な分子です。ATPは、細胞の様々な生化学的プロセスにおいてエネルギー通貨として機能し、生物が生きるために必要なエネルギーを提供します[1][5][8][15][18].
● ATPの生成と利用
1. 解糖系:
解糖系では、グルコースがピルビン酸に分解される過程で、少量のATPが生成されます。この過程は酸素が不足していても進行することができ、エネルギーを迅速に供給する手段となります[1][4][14].
2. クエン酸回路(TCAサイクル):
ピルビン酸はミトコンドリアに取り込まれ、アセチルCoAに変換された後、クエン酸回路に入ります。このサイクルを通じて、さらに多くの電子運搬体が生成され、ATPの生成に寄与します[1][4][14].
3. 電子伝達系と酸化的リン酸化:
クエン酸回路で生成された電子運搬体(NADHとFADH2)は、ミトコンドリアの内膜にある電子伝達系を通じて酸素と反応し、大量のATPを生成します。この過程は酸化的リン酸化と呼ばれ、生体内で最も多くのATPを生産する主要な経路です[1][4][14].
● ATPの生理的役割
– 筋収縮: ATPは筋肉の収縮に直接関与しています。ATPはアクチンとミオシンの相互作用を促進し、筋収縮を引き起こすために必要なエネルギーを提供します[18].
– 能動輸送: 細胞膜を通じてイオンや他の分子を輸送する際、ATPはポンプやトランスポーターの動力源として利用されます。これにより、細胞内外の物質の濃度勾配を維持することが可能です[18].
– 生合成: ATPは、糖新生や脂質合成など、新しい生体分子を合成する過程でエネルギー源としても使用されます[18].
ATPは、これらのプロセスを通じて、細胞や生物全体の生理的、代謝的機能を支える基盤を形成しています。そのため、ATPは生体のエネルギー通貨として非常に重要な役割を果たしているのです[5][8][15][18].
- 参考文献・出典
-
[1] miraiecosharing1.com/page-6313/
[2] www.kyoto-u.ac.jp/ja/research-news/2022-04-25
[3] www.gunma-u.ac.jp/information/127008
[4] www.photosynthesis.jp/ATP.pdf
[5] www.kyoto-su.ac.jp/project/st/st11_06.html
[6] www.dnszone.jp/nutrition_guide/1-3/
[7] www.e-healthnet.mhlw.go.jp/information/dictionary/exercise/ys-008.html
[8] nitta-monitoring.com/sanitary/atp/adenosine-triphosphate/
[9] www.tmd.ac.jp/artsci/biol/textbook/mitocho.htm
[10] www.zscaler.jp/resources/security-terms-glossary/what-is-advanced-threat-protection
[11] www.try-it.jp/chapters-10282/sections-10366/lessons-10371/point-2/
[12] www.e-healthnet.mhlw.go.jp/information/exercise/s-02-001.html
[13] www.try-it.jp/chapters-10282/sections-10366/lessons-10371/
[14] www.almediaweb.jp/diabetes_dialysis/diabetes_dialysis-003/part2/02.html
[15] photosyn.jp/pwiki/
[16] y-arisa.sakura.ne.jp/link/yamadaka/animal-cell/gene/ATP-1.htm
[17] licensecounter.jp/microsoft365/faq/case82.html
[18] ja.wikipedia.org/wiki/%E3%82%A2%E3%83%87%E3%83%8E%E3%82%B7%E3%83%B3%E4%B8%89%E3%83%AA%E3%83%B3%E9%85%B8
代謝経路におけるリン酸化の具体的な例
リン酸化は細胞の代謝経路において重要な役割を果たしています。リン酸化とは、特定の分子にリン酸基を付加することで、その分子の活性や機能を調節する生化学的プロセスです。以下に、代謝経路におけるリン酸化の具体的な例を挙げます。
1. 解糖系におけるリン酸化
解糖系は、グルコースをピルビン酸に変換する一連の反応であり、エネルギーを生成する主要な経路の一つです。この過程で、リン酸化は複数の段階で発生します。例えば、グルコースが細胞に取り込まれた直後、グルコース-6-リン酸に変換されることで細胞内に留まるようになります。この反応はヘキソキナーゼまたはグルコキナーゼによって触媒され、ATPからリン酸基がグルコースに転移されます[8]。
2. ATP合成におけるリン酸化
ATP合成は、細胞のエネルギー通貨であるATPを生成する過程です。ミトコンドリアの酸化的リン酸化経路では、電子伝達鎖を通じてプロトンがミトコンドリアの内膜を越えて移動し、最終的にATP合成酵素(ATPシンターゼ)がADPと無機リン酸からATPを合成します。このプロセスは、プロトンの動機力を利用して行われ、エネルギー効率の高い方法でATPを合成します[1]。
3. タンパク質のリン酸化と細胞のシグナル伝達
タンパク質のリン酸化は、細胞のシグナル伝達経路において中心的な役割を果たします。例えば、多くの受容体タンパク質は、リガンドが結合すると特定のチロシン残基がリン酸化され、これがシグナル伝達のカスケードを引き起こします。このリン酸化は、細胞の成長、分化、代謝調節など多岐にわたる生理的プロセスを制御します[6]。
4. クレアチン代謝とリン酸化
乳がん細胞におけるクレアチン代謝経路の研究では、クレアチンリン酸化がエネルギー代謝において重要な役割を果たしていることが示されています。クレアチンリン酸は、細胞内での迅速なエネルギー供給源として機能し、特に筋肉細胞の収縮など、短期間で高いエネルギーが要求される状況で重要です[4]。
これらの例からもわかるように、リン酸化は細胞のエネルギー代謝だけでなく、広範囲にわたる生物学的プロセスを調節するために不可欠です。
- 参考文献・出典
-
[1] www.photosynthesis.jp/lec/rikadai5-3.html
[2] leading.lifesciencedb.jp/2-e012
[3] www.jstage.jst.go.jp/article/kagakutoseibutsu1962/18/7/18_7_416/_pdf
[4] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2019.910236/data/index.html
[5] www.almediaweb.jp/diabetes_dialysis/diabetes_dialysis-003/part2/02.html
[6] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/phosphorylation.html
[7] www.jstage.jst.go.jp/article/jsnfs/76/4/76_217/_pdf
[8] ja.wikipedia.org/wiki/%E3%83%AA%E3%83%B3%E9%85%B8%E5%8C%96
第4章: ATPリン酸化と疾患
エネルギー代謝異常が引き起こす疾患
ATP(アデノシン三リン酸)は、細胞のエネルギー通貨として機能し、生命活動に必要なエネルギーを提供します。ATPの産生、利用、再合成の過程は、細胞の健康と機能にとって極めて重要です。ATPの産生が不十分または異常である場合、多くの疾患が引き起こされる可能性があります。
● ミトコンドリア疾患
ミトコンドリア疾患は、ミトコンドリアの機能障害によりATP産生が低下し、全身性の臓器障害が起こる疾患です。ミトコンドリアは細胞内でATPを産生する主要な場所であり、その機能障害は、脳、心臓、筋肉、肝臓など多くの臓器に影響を及ぼします[1][15]。特に、ミトコンドリア疾患はエネルギー要求が高い組織で顕著な症状を示し、神経系や筋肉の障害が一般的です[10]。
● 糖尿病
糖尿病では、インスリンの作用不足やインスリン抵抗性により、細胞内でのグルコースの利用が阻害され、ATP産生が低下します。特に、ミトコンドリアの機能障害は糖尿病患者の骨格筋で観察され、エネルギー代謝の低下が見られます[12]。これにより、高血糖状態が持続し、さまざまな合併症を引き起こす可能性があります。
● 心筋梗塞
心筋梗塞は、冠動脈が閉塞し心筋が虚血状態になることで発生します。虚血状態では、ミトコンドリアによるATP産生が阻害され、心筋細胞の機能が低下します[2][8]。これにより、心筋の収縮力が低下し、最終的には心不全を引き起こす可能性があります。
● ATP産生と疾患の関連
ATP産生の異常は、これらの疾患だけでなく、老化、がん、神経変性疾患など、多くの健康問題と関連しています。ミトコンドリアの機能不全は、細胞死や組織の損傷を引き起こし、病態の進行に寄与することが知られています[19]。
これらの疾患において、ATP産生の効率を改善する治療戦略が研究されています。例えば、ミトコンドリアをターゲットとした治療薬の開発や、代謝を調節する薬剤の使用が検討されています[9]。これにより、疾患の進行を遅らせるか、症状を軽減することが期待されます。
- 参考文献・出典
-
[1] www.tohoku.ac.jp/japanese/newimg/pressimg/tohokuuniv-press20170601_01web.pdf
[2] jscvs.or.jp/surgery/0_3_syujutu_kaisinjutu/
[3] www.jstage.jst.go.jp/article/shinzo/52/2/52_192/_pdf/-char/ja
[4] medical.nikkeibp.co.jp/leaf/all/di/digital/201803/555119.html
[5] med.toaeiyo.co.jp/contents/cardio-terms/pathophysiology/2-14.html
[6] serotec-labo.com/?page_id=2094
[7] www.med.niigata-u.ac.jp/mit/ourresearch/
[8] www.jmedj.co.jp/journal/paper/detail.php?id=10996
[9] katosei.jsbba.or.jp/view_html.php?aid=1453
[10] www.msdmanuals.com/ja-jp/professional/19-%E5%B0%8F%E5%85%90%E7%A7%91/%E9%81%BA%E4%BC%9D%E6%80%A7%E4%BB%A3%E8%AC%9D%E7%96%BE%E6%82%A3/%E3%83%9F%E3%83%88%E3%82%B3%E3%83%B3%E3%83%89%E3%83%AA%E3%82%A2%E9%85%B8%E5%8C%96%E7%9A%84%E3%83%AA%E3%83%B3%E9%85%B8%E5%8C%96%E9%9A%9C%E5%AE%B3
[11] www.tmghig.jp/research/topics/202210-14601/
[12] www.jstage.jst.go.jp/article/shinzo/42/4/42_4_564/_pdf/-char/ja
[13] www2.huhs.ac.jp/~h990002t/resources/downloard/15/15biochem3/04glycogen_glyconeogenesis15.pdf
[14] www.youtube.com/watch?v=YCPIkA5BG9A
[15] www.tmhp.jp/shinkei/section/medical-department/child-neurology/child-neurology-disease/mitochondrial.html
[16] www.ptglab.co.jp/products/featured-products/ampk/
[17] numon.pdbj.org/mom/182?l=ja
[18] www.almediaweb.jp/diabetes_dialysis/diabetes_dialysis-003/part2/02.html
[19] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2022.940882/data/index.html
[20] www.jstage.jst.go.jp/article/kagakutoseibutsu/59/7/59_590711/_pdfリン酸化関連の疾患への治療戦略
ATPリン酸化は、生体内でのエネルギー変換の中心的なプロセスであり、細胞の機能と生存に不可欠です。このプロセスは、特にミトコンドリアの酸化的リン酸化において重要で、ATPの生成に関与しています。しかし、リン酸化の異常は多くの疾患の原因となり得るため、リン酸化関連の疾患に対する治療戦略の開発が重要です。
リン酸化酵素の活性の異常は、がん細胞の増殖や薬剤感受性に大きな影響を与えることが知られています。国立がん研究センターによる研究では、体内でのがんリン酸化シグナルを高精度に定量する技術が開発され、がん治療の新たな可能性が示されました[2]。この技術は、がんの精密医療において、患者ごとのリン酸化シグナルの特性を明らかにし、個別化された治療法の選択に貢献することが期待されています。
また、リン酸化酵素阻害薬によるケミカルバイオロジー研究の展開が進んでおり、ATP結合部位の選択的スプライシングやスクリーニングなどの手法が用いられています[3]。これらの研究は、リン酸化酵素の活性を抑制することで、特定の疾患の治療に応用することを目指しています。
酸化的リン酸化の抑制が、進行性骨化性線維異形成症(FOP)の新たな治療法に繋がる可能性も示されています。京都大学の研究では、酸化的リン酸化阻害剤が骨化の起源となる細胞におけるATP産生量を減少させることで、疾患の進行を抑制することが示唆されました[5]。
ミトコンドリア酸化的リン酸化障害は、特に中枢神経系、網膜、筋に影響を及ぼす疾患であり、乳酸アシドーシスを引き起こすことがあります[6]。このような障害に対する治療戦略としては、ミトコンドリア機能を改善する薬剤の開発や、遺伝子治療によるアプローチが考えられます。
タンパク質のリン酸化を抑制することで、損傷した視神経の再生を促進する研究も行われており、緑内障などの疾患への有効性検証が期待されています[12]。
これらの研究は、リン酸化関連の疾患に対する治療戦略の開発において重要な進展を示しており、将来的には多くの疾患に対する新たな治療法の確立に繋がる可能性があります。
- 参考文献・出典
-
[1] bsd.neuroinf.jp/wiki/%E3%83%81%E3%83%AD%E3%82%B7%E3%83%B3%E3%83%AA%E3%83%B3%E9%85%B8%E5%8C%96
[2] www.ncc.go.jp/jp/information/pr_release/2019/1226/index.html
[3] www.jstage.jst.go.jp/article/fpj/132/1/132_1_22/_pdf
[4] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/phosphorylation.html
[5] www.cira.kyoto-u.ac.jp/j/pressrelease/news/240311-150000.html
[6] www.msdmanuals.com/ja-jp/professional/19-%E5%B0%8F%E5%85%90%E7%A7%91/%E9%81%BA%E4%BC%9D%E6%80%A7%E4%BB%A3%E8%AC%9D%E7%96%BE%E6%82%A3/%E3%83%9F%E3%83%88%E3%82%B3%E3%83%B3%E3%83%89%E3%83%AA%E3%82%A2%E9%85%B8%E5%8C%96%E7%9A%84%E3%83%AA%E3%83%B3%E9%85%B8%E5%8C%96%E9%9A%9C%E5%AE%B3
[7] www.jst.go.jp/kisoken/crest/report/sh_heisei11/nou_mamoru/kakizuka.pdf
[8] www.med.kobe-u.ac.jp/icms/icms/research_cancer.html
[9] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-21K07284/
[10] www.jstage.jst.go.jp/article/joma1947/115/1/115_1_1/_pdf/-char/ja
[11] www.amed.go.jp/news/release_20220328-01.html
[12] www.ncnp.go.jp/topics/2019/20190514.html
第5章: ATPとリン酸化の研究進展
ATP(アデノシン三リン酸)は、生物の細胞内でエネルギーを運搬するための普遍的な分子であり、リン酸化は生体内での重要な化学反応の一つです。これらの分野における研究は、生命科学や医学、さらにはエネルギー代謝に関する基礎研究から応用研究に至るまで幅広い進展を遂げています。未来の研究方向性としては、以下のような成果が期待されます。
1. 新技術の開発
– 分子モーターやナノマシンの設計において、ATPをエネルギー源とする新たなシステムの開発が進むことが期待されます。例えば、自然界にある分子モジュールから人工的な分子モーターの創出に成功した研究[1]は、ナノスケールでの精密な物質輸送や機械的動作を実現するための基盤技術となり得ます。2. 応用研究の進展
– ATP合成やリン酸化反応に関わる酵素の構造と機能の解明により、新しい薬剤の開発や代謝疾患の治療法の創出が進むことが期待されます。特に、ミトコンドリア病とその治療薬開発に向けた研究[3]は、難治性疾患の治療法開発に貢献する可能性があります。3. 疾患治療への応用
– ATP産生の効率化やリン酸化酵素の調節による疾患治療への応用が進むことが期待されます。例えば、ミトコンドリア酵素の阻害剤による新しい抗がんメカニズムの発見[12]は、がん治療における新たなアプローチとなり得ます。4. 環境への影響
– ATPとリン酸化の研究は、環境に優しいエネルギー利用の可能性を探るための基盤となります。例えば、新規リン酸化酵素がATPでなくピロリン酸を利用する仕組みの解明[18]は、環境にやさしいリン酸化物生産法の産業利用を可能にすることが期待されます。これらの研究進展は、生命の基本的なエネルギー代謝メカニズムの理解を深めるだけでなく、医薬品開発、エネルギー生産、環境保全など、人類の持続可能な発展に貢献する多岐にわたる応用が期待されます。
- 参考文献・出典
-
[1] www.nict.go.jp/press/2016/11/15-1.html
[2] www.yodosha.co.jp/jikkenigaku/keyword/3446.html
[3] katosei.jsbba.or.jp/view_html.php?aid=1453
[4] www.jst.go.jp/pr/announce/20090901/index.html
[5] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2021.930760/data/index.html
[6] www.cosmobio.co.jp/product/detail/ampk-antibody-pgi.asp?entry_id=38059
[7] www.jstage.jst.go.jp/article/fpj/132/1/132_1_22/_pdf
[8] www.jstage.jst.go.jp/article/bunsekikagaku/71/3/71_179/_pdf
[9] numon.pdbj.org/mom/50?l=ja
[10] www.k.u-tokyo.ac.jp/information/category/press/9462.html
[11] www.kyoto-su.ac.jp/project/st/st11_06.html
[12] www.amed.go.jp/news/release_20211208-02.html
[13] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2021.930684/data/index.html
[14] www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/phosphorylation.html
[15] www.med.niigata-u.ac.jp/mit/ourresearch/
[16] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-21H02914/
[17] kenko.sawai.co.jp/theme/202106.html
[18] www.kyoto-u.ac.jp/ja/research-news/2018-05-16-0
[19] www.aist.go.jp/aist_j/press_release/pr2016/pr20160108/pr20160108.html
[20] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2022.940882/data/index.html









