コイルドコイル coiled coilとは?
標準的なコイルドコイルは、abcdefgと表示されたヘプタッド・リピートから形成されており、その中ではaとdの位置の疎水性アミノ酸が保存されている。疎水性アミノ酸が3残基と4残基の間で交互に保存されていること(平均3.5残基)は、通常のα-helixの1ターンあたりのアミノ酸の周期性3.6に近い。その結果、このような繰り返し配列から作られたヘリックスは、疎水性の面と極性の面の両方を持つ、独特の両親媒性を示す。2つのヘリックスが疎水性の面を介して結合すると、コイルドコイルが形成される。しかし、2つのらせんをくっつけて疎水性の接触を維持するためには、側鎖のノブ・イン・ホールパッキングにより、これらの残基がターンごとに同等の位置を占める必要がある。ヘリックスを互いにスーパーコイル化することで、スーパーコイル軸に対する周期性が3.6から3.5へと効果的に減少する。これにより、側鎖の位置は、らせん表面8上を連続的に漂うのではなく、2ターン後、つまり7残基後に繰り返されることになる。
コイルドコイルの役割・機能
コイルドコイルは、生命の3つの王国(微生物、動物、植物)のすべてのタンパク質に見られる。あるタンパク質のコイルドコイルのドメインは、配列と長さがほとんど変わらず、コイルドコイルの全長にわたってアミノ酸が構造的、機能的な役割を果たしていることを示している。他のコイルドコイルは、配列は異なるが長さは保存されており、分子スペーサーとして機能している。このようにして、コイルドコイルタンパク質は、中心核やゴルジ体などのオルガネラの構造に影響を与え、輸送小胞を繋ぎ止めることができる。モータータンパク質に見られるような特殊なコイルドコイルは、その長さに沿って構造変化を伝播することができ、それによって貨物の結合やモーターの処理能力を調節することができる。また、酵素においても、コイルドコイルは分子の定規として機能し、触媒作用を一定の距離に配置していることが確認されている。コイルドコイルは、巨大な高分子複合体の核や足場となる可能性があることが広く議論されているが、それを立証する構造的な証拠は比較的少ない。
コイルドコイルの構造
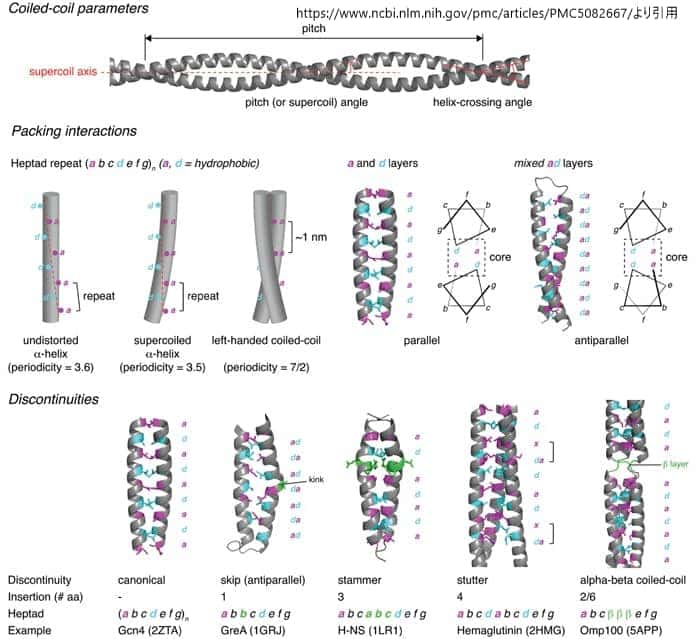
Coiled-coil architecture. コイルドコイルのパラメータ。コイルドコイルの基本的なパラメータは、ピッチ(スーパーコイルの周期性)、ピッチ(またはスーパーコイル)角度(スーパーコイル軸に対するらせんの角度)、らせん交差角度(2つのらせんが互いに交差する角度)である。パッキング相互作用。標準的なコイルドコイルは、aとdの位置に疎水性残基が保存されているヘプタッドリピートで特徴付けられる。歪んでいないαヘリックスは、ヘリックスの非整数周期性のため、横に並んだ状態ではパッキングできない(3.6)。ヘリックスを重ねることで、周期性は3.5に減少し、7/2の周期性を持つ左巻きのコイルドコイルができあがる。平行に配置された2つのスーパーコイルドヘリックスのノブ・イン・ホールパッキングでは、a層とd層が形成され、逆平行のヘリックスではad層が混在する。不連続性。1、2、3、4、または6個のアミノ酸を挿入すると、ヘプタッドリピートが不連続になり、コイルドコイルの局所的な構造が変形する。GCN4の標準的なコイルドコイルと比較して、1、3、4、2/6個のアミノ酸を挿入した場合の例を示す。(出典)








