目次
コヒーシンは細胞分裂、特に減数分裂の際に姉妹染色体がたがいに付着して遺伝子を組み替えたり、1本ずつ娘細胞にわかれたりするのに非常に重要な役割を果たすタンパク複合体です。
コヒーシンは、姉妹染色体の凝集、相同組換え、DNAループ化を媒介するタンパク質複合体です。
コヒ―シンは、SMC3、SMC1、SCC1、SCC3(ヒトではSA1またはSA2)から構成されているタンパク複合体です。コヒーシンは、DNA複製後に姉妹染色体が分離するアナフェーズまで、姉妹染色体をつなぎとめています。このタンパク複合体はリング状の構造を形成しており、姉妹染色体はコヒーシン環の内側に巻き込むことで一緒に保持されていると考えられています。コヒーシンは、コンデンシン、MukBEF、SMC-ScpABを含むSMCファミリーのタンパク質複合体のメンバーです。
コヒーシンの構造
コヒーシンは、SMC1、SMC3、RAD21およびSCC3(SA1またはSA2)からなるマルチサブユニットタンパク質複合体です。
有糸分裂期の染色体の適切な組み立てにおおいて、コンデンシンとともにコヒーシンがその制御をすることがわかってきました。
structural maintenance of chromosomes(SMC)タンパク質
SMCタンパク質は、高次の染色体組織とダイナミクスの多くの側面に関与するATPaseの大規模なファミリーです。SMCはStructural Maintenance of Chromosomesの略で、染色体の構造維持がその機能であることを意味しています。
structural maintenance of chromosomes(SMC)タンパク質は、2つの主要な構造的特徴を有しています。
1.ATPase活性を有するATP結合カセット様の「ヘッド」ドメイン(N-末端とC-末端の相互作用によって形成される)
2.SMCの二量体化を可能にするヒンジドメイン
です。
ヘッドおよびヒンジドメインは、長い反平行コイル状のコイルを介して互いに接続されています。二量体は、ヒンジによって連結されたV字型の形態で存在します。
RAD21
RAD21のN末端ドメインは2つのα-ヘリックスを含み、SMC3のコイル状コイルと3つのらせん束を形成します。RAD21のC末端ドメインは、Smc1ヘッドドメイン内の2つのβシートと結合する翼状のらせんを形成している。
RAD21がSMCタンパクに結合すると、SCC3もまたRAD21と結合することができるようになります。RAD21がSMC1とSMC3の両方に結合すると、コヒーシン複合体は閉環構造を形成するようになります。SMCサブユニットとRAD21の間の界面が開き、DNAがコヒーシンリングに出入りできるようになります。
コヒーシン複合体全体の構造
多くのサブユニットとその界面の構造はわかっていますが、コヒーシン複合体全体の構造はまだ解明されていません。コヒーシンの構造に関しては、主に電子顕微鏡によりえられてきました。コヒーシンは環状、細長い棒状、そして最近では折り畳まれた構造を含む多くの構造を持っていることが明らかになってきましたが、細胞内でどのような構造が優勢なのか、また試料調製によってその形が誘導されるのかどうかはまだわかっていません。
コヒーシンの機能
コヒーシン環には多くの機能があります。
1. コヘシン環は、分裂期(および減数分裂期)の間、各姉妹染色体が反対側の極に分離していくことを確実にするために、メタフェースの間、姉妹染色体を互いに連結させておくために使用されます。コヒーシンがなければ、各姉妹染色体に取り付けられた紡錘体繊維が異なる極から来ているかどうかを確実にする方法がないので、細胞は姉妹染色体の不分離を制御することができません。
2. 紡錘体の染色体への付着を容易にします。
3. 組換えによるDNA修復を容易にします。
4. 近年、コヒーシンの多くの新しい機能が、様々な細胞のプロセスで発見されています。コヒーシンは、転写制御、DNA二本鎖切断修復、染色体凝縮、第一減数分裂期における相同染色体のペアリング、第一減数分裂期における姉妹キネトコアの単一配向、非相同セントロメア結合、染色体構造と再配列、DNA複製などに関与していることが示されています。
コヒーシン複合体の研究進展と未来の展望
コヒーシンの接着メカニズムと染色分体の分配
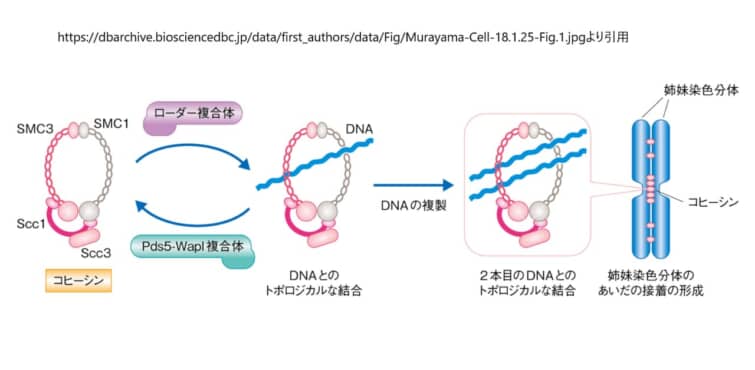
コヒーシンは姉妹染色体の接着において中心的な役割を果たすタンパク質複合体であり、細胞分裂時の染色分体の正確な分配に不可欠です。コヒーシンは、姉妹染色体を物理的に結合させることで、それらが分離するまで一緒に保持するリング状の構造をしています。このリングは、細胞周期の特定の段階で、特に有糸分裂のメタフェーズからアナフェーズへの遷移時に、セパラーゼという酵素によって切断されることで染色体が分離し、均等に娘細胞に分配されるようになります。
● コヒーシンの機能と細胞分裂時の役割
コヒーシンは、SMC1、SMC3、SCC1(またはRAD21)、およびSCC3などのサブユニットから構成されています。これらのサブユニットはリング状の構造を形成し、姉妹染色体のDNAを囲むことで接着します[9][13]。コヒーシンのリングは、細胞周期のS期にロードされ、姉妹染色体が複製された後にそれらを一緒に保持します。そして、細胞が分裂する際には、アナフェーズの開始時にセパラーゼによってSCC1が切断され、姉妹染色体が分離して娘細胞に均等に分配されるようになります[4][16]。
● コヒーシンの異常と染色体分配の不具合
コヒーシンの機能不全は、染色体の不均等分配を引き起こし、がんや先天性疾患などの多くの病態に関連しています。例えば、コヒーシンの異常は、クロモソーム不安定性を引き起こし、細胞の異常な分裂やがんの進行につながる可能性があります[14][19]。
● 最新の研究成果
早稲田大学の研究では、急性骨髄性白血病(AML)の原因となるSET/TAF1がん遺伝子が、染色体分配を正確に制御していることが発見されました。この研究は、がん遺伝子産物であるSETタンパク質の異常が、細胞をがん化する分子機構を世界で初めて解明したものであり、がんの治療や抗がん剤の創薬研究に貢献することが期待されています[1]。
また、大阪大学の研究では、染色体と紡錘体との結合において、CENP-Tというタンパク質がCENP-Cよりも主要な役割を担っていることが明らかにされました。これは、染色体の分配異常が原因となる疾患の原因解明につながる成果です[2]。
さらに、名古屋大学の研究では、コヒーシンの構造変化がDNA複製の進行に必要であることが示されました。この構造変化は、正確な染色体分配やゲノム高次構造形成にも重要であることが示されています[7]。
これらの研究成果は、コヒーシンの動態を理解し、染色体分配のメカニズムを解明する上で重要な進展を示しており、遺伝病やがんなどの疾患の治療法の開発に寄与する可能性があります。
- 参考文献・出典
-
[1] www.waseda.jp/top/news/66394
[2] resou.osaka-u.ac.jp/ja/research/2018/20181113_1
[3] resou.osaka-u.ac.jp/ja/research/2019/20191031_2
[4] leading.lifesciencedb.jp/4-e007
[5] resou.osaka-u.ac.jp/ja/research/2019/20190111_3
[6] www.riken.jp/press/2018/20180511_1/index.html
[7] www.nagoya-u.ac.jp/researchinfo/result/2021/05/—–.html
[8] www.riken.jp/press/2015/20150529_1/index.html
[9] www.titech.ac.jp/news/2018/040354
[10] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2017.890102/data/index.html
[11] www.jstage.jst.go.jp/article/biophys/63/1/63_21/_html/-char/ja
[12] www.tmd.ac.jp/artsci/biol/textbook/celldiv.htm
[13] repository.dl.itc.u-tokyo.ac.jp/record/52327/files/A34137.pdf
[14] kaken.nii.ac.jp/ja/file/KAKENHI-PROJECT-18101007/18101007seika.pdf
[15] www.jstage.jst.go.jp/article/biophys/40/5/40_5_321/_pdf
[16] kaken.nii.ac.jp/ja/file/KAKENHI-PROJECT-22770005/22770005seika.pdf
[17] bio.nikkeibp.co.jp/atcl/news/p1/24/02/08/11577/
[18] www.jstage.jst.go.jp/article/biophys/63/1/63_21/_pdf
[19] www.nig.ac.jp/nig/images/research_highlights/PR20240124.pdf
[20] www2.kobe-u.ac.jp/~jibaklee/researchcontent.html
Uhlmann教授による核酵母のコヒーシン研究
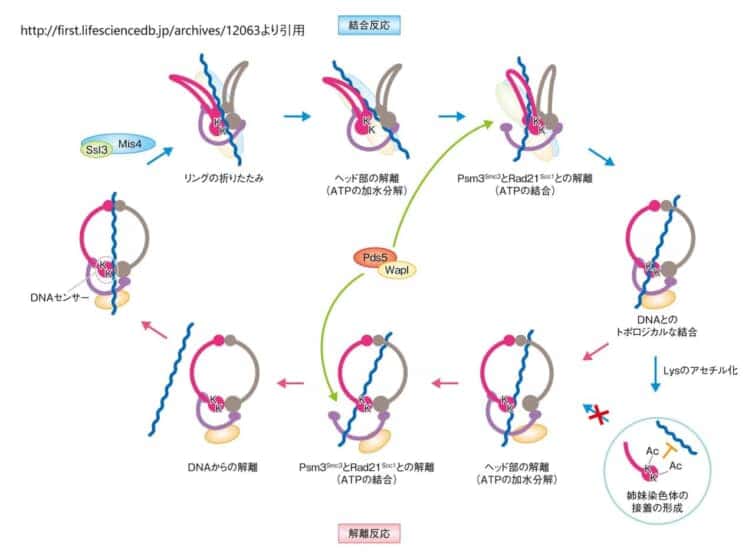
フランク・Uhlmann教授が率いる研究チームは、核酵母を用いたコヒーシンの機能解析とその生化学的プロセスに関する研究を行っています。この研究は、コヒーシンとDNAとの結合反応および解離反応を生化学的に再構成し、その一連の解析を通じてSMC複合体の機能を明らかにすることを目的としています[1]。
具体的には、研究チームはコヒーシンのリング状の構造がDNAとどのように相互作用するかを解析しています。コヒーシンは、姉妹染色分体の接着に中心的な役割を果たすタンパク質複合体であり、細胞分裂時に染色体が均等に分配されることを保証するために不可欠です。この研究では、組換えタンパク質から再構成したコヒーシンを用いて、接着を実現する分子メカニズムを理解することを目指しています[3]。
また、コヒーシンがゲノム構造の3次元組織化に重要な役割を担っていることが、ChIA-PETやin situ Hi-Cといったゲノミクス法を用いた研究によって示されています。これらの研究では、コヒーシンによって仲介されるゲノム領域間の相互作用を包括的にマッピングし、コヒーシンが形成するゲノム構造が細胞周期を通してどのように変化するかを解析しています[2]。
Uhlmann教授のチームは、コヒーシンの機能解析において、コヒーシンリングの構造変化を阻害することで染色体の分配や複製の進行だけでなく、クロマチンの高次構造形成が正常に行われなくなることを明らかにしています。この研究は、単一分子イメージングや染色体形態観察に基づいて行われており、コヒーシンがDNAループ押出し活性を持つことや、その活性が塩濃度感受性を持つことなど、コヒーシンの分子機構に関する重要な知見を提供しています[8]。
これらの研究成果は、コヒーシンの分子機構の理解を深めるだけでなく、コヒーシンの機能不全が原因とされる疾患や不妊の原因解明に繋がることが期待されます。Uhlmann教授のチームによる核酵母を用いたコヒーシンの機能解析は、染色体生物学および分子生物学の分野における基礎研究として、その重要性を示しています。
- 参考文献・出典
-
[1] first.lifesciencedb.jp/12063
[2] www.igm.hokudai.ac.jp/3dgenome/ja/research.html
[3] kaken.nii.ac.jp/file/KAKENHI-PROJECT-22770201/22770201seika.pdf
[4] kaken.nii.ac.jp/ja/file/KAKENHI-PROJECT-18101007/18101007seika.pdf
[5] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2017.890515/data/index.html
[6] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2017.890525/data/index.html
[7] kaken.nii.ac.jp/ja/file/KAKENHI-PROJECT-20H05686/20H05686_chukan_hyoka_gaiyo_ja.pdf
[8] www.jstage.jst.go.jp/article/biophys/63/1/63_21/_html/-char/ja
コヒーシンの機能障害と関連疾患
コヒーシン欠損が引き起こす染色体異常
● コヒーシンの機能と染色体異常分配
コヒーシンは、DNAを複製した後の姉妹染色分体を一時的に結合させることで、細胞分裂時に染色体が正確に分配されることを保証します。このプロセスは、細胞の遺伝情報が次世代の細胞に正確に伝達されるために不可欠です。コヒーシンの機能不全は、染色体の異常分配を引き起こし、細胞の遺伝情報が不正確に伝達される原因となります[1][6]。
● コヒーシン欠損による疾患
コヒーシンの機能不全は、コルネリア・デ・ランゲ症候群(CdLS)やロバーツ症候群(RBS)などの遺伝性疾患の原因として同定されています。これらの疾患は、成長障害、発達遅滞、特異顔貌、重篤な四肢欠損などを特徴とし、コヒーシンのサブユニットの変異によって引き起こされます[12][13]。また、コヒーシンの機能不全は、白血病や骨髄異形成症候群(MDS)などの血液がんの原因遺伝子異常としても関連しています[5]。
● 生命科学における影響
コヒーシンの機能不全による染色体異常分配の研究は、遺伝性疾患の原因解明や治療法の開発に貢献しています。特に、コヒーシン関連疾患の分子メカニズムの解明は、これらの疾患の診断や治療に新たなアプローチを提供する可能性があります。さらに、コヒーシンの機能不全が関与するがんの研究は、がん治療薬の開発やがんの予防策の確立に役立つことが期待されています[5][12][13]。
コヒーシンの機能不全による染色体異常分配の研究は、生命科学の分野において重要な課題の一つであり、遺伝性疾患やがんなどの疾患の理解と治療に向けた基礎研究として今後も注目されていくでしょう。
- 参考文献・出典
-
[1] resou.osaka-u.ac.jp/ja/research/2017/20170413_2
[2] www.riken.jp/medialibrary/riken/pr/publications/news/2010/rn201004.pdf
[3] www.u-tokyo.ac.jp/focus/ja/press/p01_240813.html
[4] leading.lifesciencedb.jp/4-e007
[5] www.kyoto-u.ac.jp/ja/archive/prev/news_data/h/h1/news6/2013/130819_1
[6] www.titech.ac.jp/news/2018/040354
[7] resou.osaka-u.ac.jp/ja/research/2022/20220331_2
[8] leading.lifesciencedb.jp/1-e004
[9] resou.osaka-u.ac.jp/ja/research/2019/20190111_3
[10] www.u-tokyo.ac.jp/focus/ja/press/p01_260306.html
[11] www.kumamoto-u.ac.jp/daigakujouhou/kouhou/kouhoushi/kumadainow/labo/2019/20191011
[12] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2017.890525/data/index.html
コヒーシン病の分子生物学的基盤
コヒーシン病は、コヒーシン複合体やその制御因子の遺伝子変異によって引き起こされる一連の遺伝性疾患を指します。コヒーシンは染色体の姉妹染色分体間の接着や、遺伝子の発現制御、染色体の高次構造の維持に重要な役割を果たすタンパク質複合体です。この複合体の異常は、発達遅延、神経発達障害、白血病など多様な症状を引き起こすことが知られています。
● コヒーシンの機能と病態メカニズム
コヒーシンは、染色体の正確な複製と分離を保証するために必要なタンパク質複合体であり、細胞分裂時に姉妹染色分体を一緒に保持する役割を果たします。また、遺伝子の発現制御にも関与しており、エピジェネティックな制御において中心的な役割を担っています[3][5]。
● コヒーシン病の例
コヒーシン病の代表例としては、コーネリア・デ・ランゲ症候群(CdLS)やロバーツ症候群があります。これらの疾患は、コヒーシンのサブユニットあるいはその制御因子の変異によって起こり、発生異常を伴います[5]。CdLSでは、遺伝子発現の低下やコヒーシンローダー及びBRD4の局在減少が遺伝子制御異常を引き起こすメカニズムの一つとして示されています[6]。
● コヒーシン変異による白血病の病態解明
コヒーシン遺伝子の変異は、特定の白血病、特に骨髄異形成症候群(MDS)、慢性骨髄性白血病(CMML)、急性骨髄性白血病(AML)において高頻度で見られます。これらの変異は、染色体の正常なリング状の複合体の形成を妨げ、染色体への正常な結合を阻害することで白血病化を促進すると考えられています[2]。また、コヒーシン遺伝子変異を有する白血病細胞株に正常型のコヒーシンタンパク質を外因性に発現させると、細胞株の異常な増殖が抑制されることが観察され、コヒーシン遺伝子ががん抑制遺伝子としての機能を持つことが示唆されています[2]。
● 研究の意義
コヒーシン病に関する研究は、遺伝性疾患の分子生物学的基盤の理解を深めるだけでなく、新たな治療法の開発に向けた基礎を提供します。特に、コヒーシン変異に基づく白血病の病態解明と新規治療法の開発に関する研究は、患者の診療において重要な意義を持ちます[11][12]。これらの研究成果は、コヒーシン病の患者における症状の発現メカニズムの理解を深め、より効果的な治療戦略の開発に貢献する可能性があります。
コヒーシンの分子構造と複製の調節
コヒーシンは、姉妹染色分体の結合とゲノムの安定性を維持するために重要な役割を果たすリング状のタンパク質複合体です。この複合体は、特にDNAの複製中に染色体の正確な分離を保証するために不可欠です。コヒーシンのリング構造は、DNAを物理的に囲むことで、姉妹染色分体が正確に分離されるように保持します。このセクションでは、コヒーシンのリング構造がどのようにDNAと相互作用し、ゲノムの安定性にどのように寄与しているかについて詳しく説明します。
● コヒーシンのリング構造とDNAの捕捉
コヒーシンは、Smc1、Smc3、Scc1(またはRad21)、およびSA(またはSTAG)という四つのコアサブユニットから構成されるリング状の構造を持っています。このリングは、DNA分子を物理的に囲むことができ、姉妹染色分体の間に安定した結合を形成します。DNAの複製中に、コヒーシンは新しく複製されたDNAにロードされ、姉妹染色分体間の結合を確立します[4][19]。
● DNA複製とコヒーシンの機能
DNAが複製される際、コヒーシンは複製フォークの近くで活性化され、新しく複製された姉妹染色分体を捕捉し、それらがセルサイクルの後半まで連結されるようにします。このプロセスは、特にS期とG2期に重要で、染色体の安定性と正確な分離に寄与します[4][20]。
● コヒーシンのリング構造の力学的安定性
コヒーシンのリングは、非常に高い力学的安定性を持っており、細胞分裂中に姉妹染色分体を保持するために必要な力に耐えることができます。この力学的特性は、コヒーシンが染色体を正確に分離するための基本的な要件です[8]。
● クロマチン構造との相互作用
コヒーシンはクロマチン構造とも密接に関連しており、特定のクロマチン領域にコヒーシンが集積することで、遺伝子の発現調節やDNAの修復プロセスに影響を与えます。コヒーシンのクロマチンへの結合は、クロマチンの整合性と機能を維持するために重要です[2][12]。
● 結論
コヒーシンのリング構造は、DNAの複製、クロマチン構造の維持、およびゲノムの安定性の保持において中心的な役割を果たします。この複合体は、染色体の正確な分離を保証するために、DNAとの物理的な相互作用を通じて、細胞の生命サイクルにおける重要なプロセスを調節します。コヒーシンの機能不全は、染色体の不安定性や異常な細胞分裂を引き起こす可能性があり、多くの遺伝病やがんの原因となることが示されています。
分子技術を用いたコヒーシンの動的分析
コヒーシン複合体は、姉妹染色分体間の接着を担う重要なタンパク質であり、細胞分裂の正確な染色体分配に不可欠です。この複合体の動的な挙動と細胞周期における調節機構を理解するために、先進的な分子技術が活用されています。
● コヒーシンの動的分析における分子技術の応用
# 一分子動態解析
コヒーシンの一分子動態解析により、細胞周期の段階に応じて、溶液環境やコヒーシン結合因子依存的に、コヒーシン複合体全体が大きく構造変化しながら細胞内機能を果たすことが示されています。この研究では、単一分子イメージング技術を用いて、コヒーシンリングの構造変化を阻害することで、染色体の分配や複製の進行だけでなく、クロマチンの高次構造形成が正常に行われなくなることが明らかにされました[10][15]。
# ゲノムスケールのDNA設計
コヒーシン依存的な転写制御とクロマチン構造変換に関する研究では、動的クロマチン構造と機能の関係を解明するために、新しい分析技術が応用されています。これには、3D-SIMによる減数分裂コヒーシンRec8の欠失変異体のクロマチン構造解析や、シトシンのメチル化状態の解析などが含まれます[14][17]。
# ナノポーラス金属錯体の応用
ナノポーラス金属錯体を用いた研究では、ガス分子の効率的な捕捉と分離、ナノ空間を反応場とした特異な化学反応の実現、分子に応答する多孔性電子材料の開発などが行われています。これらの技術は、分子レベルでの精密な制御を可能にし、コヒーシンのような複雑な生物分子の研究にも応用可能です[13]。
# 合成可能な高分子のコンピュータ生成
合成可能な高分子をコンピュータで生成する新技術の開発は、原理的に合成可能な高分子を生成できることを示しています。この技術は、SMiPolyと機械学習・人工知能の技術を組み合わせることで、分子技術の新たな可能性を開拓しています[16]。
これらの研究事例は、分子技術がコヒーシン複合体の動的な挙動とその調節機構の解明にどのように貢献しているかを示しています。一分子動態解析、ゲノムスケールのDNA設計、ナノポーラス金属錯体の応用、合成可能な高分子のコンピュータ生成などの技術は、生物学的な複雑さを理解し、新たな治療法や技術の開発につながる可能性を秘めています。
- 参考文献・出典
-
[10] www.jstage.jst.go.jp/article/biophys/63/1/63_21/_html/-char/ja
[11] www.fujifilm.com/jp/ja/about/rd/technology/core/functional-molecule
[12] www.jst.go.jp/crest/mt/researchers/rising_star.html
[13] www.chembio.nagoya-u.ac.jp/labhp/solid1/research.html
[14] kaken.nii.ac.jp/ja/file/KAKENHI-AREA-3506/3506_kenkyu_seika_hokoku_ja.pdf
[15] www.jstage.jst.go.jp/article/biophys/63/1/63_21/_pdf
[16] prtimes.jp/main/html/rd/p/000000145.000035577.html









