目次
細胞内で膜やタンパク質は、小さい袋(小胞)に入って移動します。この移動を助けるために、タンパク質のコートが小胞の表面に形成されます。その中でも「クラスリン」というタンパク質が主に使われます。クラスリンは3本の足を持つ形状をしており、移動する膜の上に格子状のコートを作り出します。
クラスリンの発見
電子顕微鏡の写真で、細胞膜のくぼみや細胞内の小胞の境界には、硬い毛のような被膜が多角形の格子状に配置されているのが見られます。この発見から、膜小胞がバスケットの中に入っていて、このバスケットが実際に細胞膜を小さなくぼみや小胞に変形させることが可能だと半世紀前に提案されました。
その後、この重要なタンパク質成分である「クラスリン重鎖」(190kDa)が特定されました。さらに、クラスリンの軽鎖(LCaとLCb、どちらも約25kDa)という2種類も分離されました。クラスリンは3本の重鎖とそれに関連する軽鎖からなる三量体の集合体であり、クラスリンコートの基本構造は「トリスケリオン」と呼ばれる3本足の形状です。
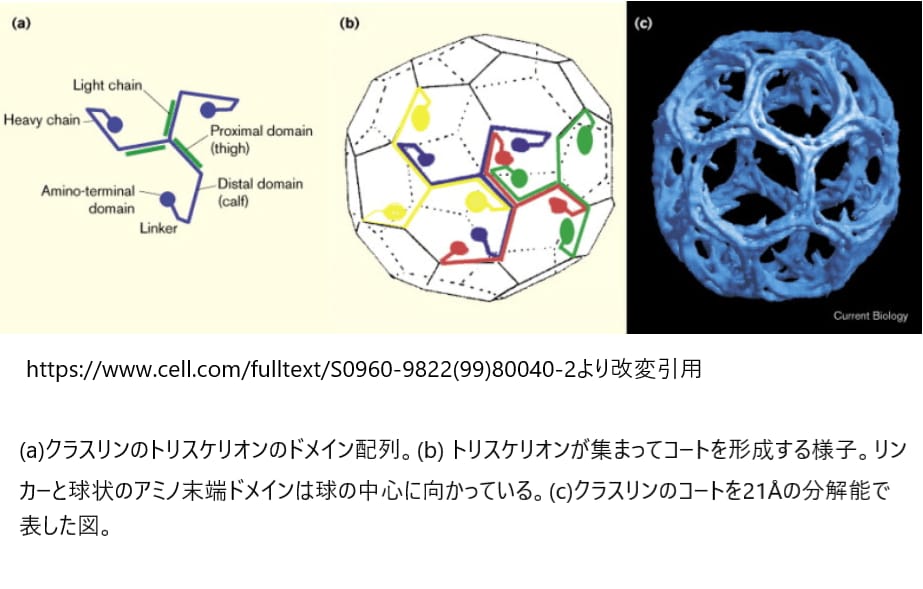
クラスリンはどこに存在するのか
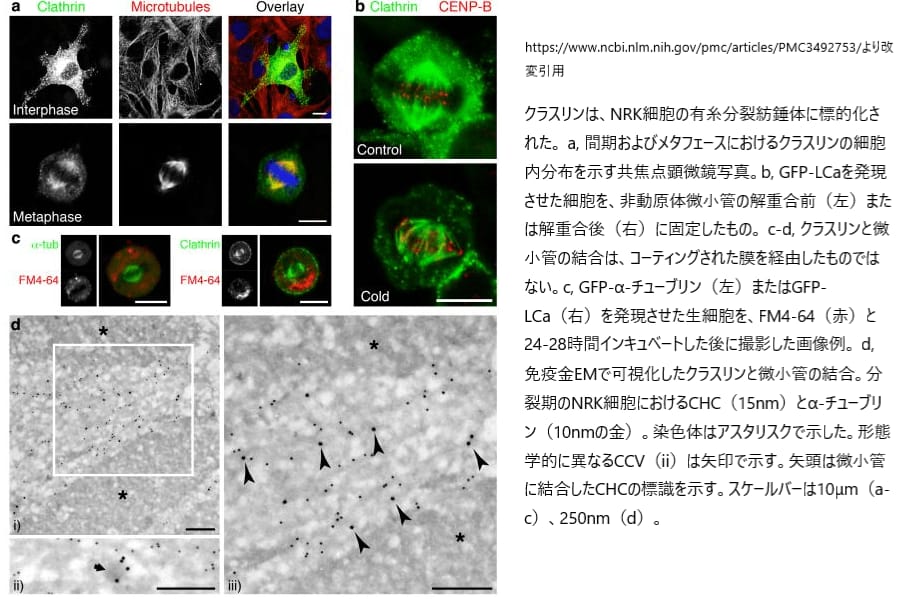
哺乳類の細胞では、クラスリンが細胞膜、細胞質、ゴルジ装置に集まっていることがわかっています。また、クラスリンは有糸分裂の際に、紡錘体の中心にあるキネトコア繊維に位置していることも明らかになっています。
具体的には、(A) 正常ラット腎臓(NRK)細胞の間期やメタフェース(細胞分裂の段階)において、GFP(蛍光タンパク質)でマークされたLCaクラスリン軽鎖とα-チューブリン(細胞骨格の一部)の分布が調べられました。これにより、クラスリンがどのように細胞内で分布しているかが可視化されました。さらに、(B)細胞を冷やしても残る安定した動原体繊維上でも、GFP-LCaの存在が確認されています。この情報は、クラスリンが細胞内でどのように機能しているかを理解するのに役立ちます。
クラスリンの機能
クラスリンを使ったエンドサイトーシスとは、特定の細胞膜タンパク質が濃縮され、効率よく細胞内に取り込まれるメカニズムです。例えば、トランスフェリン受容体や低密度リポタンパク質(LDL)受容体などの細胞表面タンパク質は、このプロセスによって内部に取り込まれます。これらの受容体は鉄分を含むトランスフェリンタンパク質やコレステロールを含むLDL粒子と結合し、それを細胞内に運びます。
クラスリンコートはターゲットの構造体に集まり、電子顕微鏡で確認できる特徴的なバスケット状の構造を形成します。クラスリンが集まることで膜の曲率が変わり、表面の膜が変形して小胞が形成されるとされています。小胞が細胞表面から切り離されると、クラスリンコートは速やかに解体され、再利用のために速やかに取り除かれます。
細胞のエンドサイトーシスにおいて、クラスリンでコートされたピットは細胞膜の約2%を覆い、その寿命は約1分とされています。これは、平均的な細胞が毎分、細胞表面の膜の約2%を内包していることを意味します。ほとんどの細胞でクラスリン介したエンドサイトーシスがピノサイトーシスの大部分を占めています。また、クラスリンが膜に集まるためには、細胞質のアダプタータンパク質が事前に細胞膜に結合している必要があります。
クラスリンはエンドサイトーシスを仲介する重要なタンパク質で、このプロセスは細胞の機能にとって非常に重要です。エンドサイトーシスを通じて、細胞は表面の受容体の密度を調整したり、必要な栄養素を取り込んだりすることができます。また、特定の細胞はこのメカニズムを利用して、シナプス伝達を行ったり、細胞表面に抗原を提示したりすることが可能です。
このプロセスの中心にあるクラスリンによるエンドサイトーシス(Clathrin Mediated Endocytosis, CME)は、細胞内で物質が適切に運ばれるために不可欠です。クラスリンは、このプロセスの必須成分であり、小胞を形成し、細胞内に取り込む際に重要な役割を担っています。
さらに、クラスリン以外にも、COP IやCOP IIなどのコート形成タンパク質が存在し、これらは細胞内の異なる領域へのカーゴの運搬を支援します。クラスリンに依存しないエンドサイトーシス経路も存在し、これらは細胞内での物質の動きを多様化させることに寄与しています。
クラスリンは、細胞内の膜交通において重要な役割を担っています。その主な機能の一つは、細胞膜の特定の部分に格子状の構造を形成することです。この構造は、細胞内の物質の運搬に関与する小胞の形成を助け、必要なタンパク質や他の分子が効率的に細胞内に取り込まれることを可能にします。
また、クラスリンは有糸分裂の過程においても重要な役割を果たします。有糸分裂中、クラスリンは紡錘体のキネトコア繊維の位置に集まり、染色体の正確な分配を支援するなど、細胞分裂の正確さと効率を高めるために機能します。
このようにクラスリンは、細胞の生命活動における基本的なプロセスであるエンドサイトーシスと細胞分裂の両方において中心的な役割を果たしています。
クラスリン介在エンドサイトーシスclathrin mediated endocytosis(CME)
エンドサイトーシスは、様々な組織における細胞膜EMや生化学的研究により、次のように進行することが明らかになっています。
- 1.貨物の捕獲とクラスリンの多量体化を伴うクラスリン被覆ピット(CCP)の核形成
- 2.膜の侵食を伴う被覆ピットの伝播
- 3.クラスリンケージの完成とダイナミンの作用によるクラスリン被覆小胞(CCV)の出芽または分裂
- 4.細胞内に入ると被覆が分解され、被覆されていない小胞が目的地まで輸送される。
クラスリンは、細胞内のさまざまな場所で膜コーティングに関与しています。具体的には、細胞膜から取り込まれたエンドサイトされた膜や、トランスゴルジネットワーク(TGN)とエンドソーム間の膜移動において、そのコーティングプロセスに中心的な役割を果たします。クラスリンが膜に直接結合するわけではなく、アダプタータンパク質を介して膜に結合します。これにより、膜上で正確な位置決めと機能的な相互作用が可能になります。
アダプタータンパク質の中で特に重要なのがアダプタータンパク質複合体(APC)で、AP-1とAP-2がその主要なクラスです。AP-2は主に細胞膜でのエンドサイトーシスに関与し、AP-1はトランスゴルジネットワークからエンドソームへの膜交通を媒介します。
さらに、β-アレスチン、ARH、dab2、numbなどの他の代替アダプタータンパク質もクラスリンに関連して膜交通を助ける役割を持っています。これらのアダプターは特定の条件や細胞タイプ、膜輸送のニーズに応じて異なる機能を果たすことで、細胞の内部環境を適切に調節しています。
関連記事:Adaptor protein complexes アダプタータンパク複合体 AP複合体
アダプタータンパク質(AP)、またはアダプチンとして知られているこれらのタンパク質は、クラスリンコーティングの過程で非常に重要な役割を果たします。クラスリンでコーティングされた小胞は三つの異なる層から構成されており、これらは細胞内の物質輸送において基本的な構造を形成します。
1. 脂質膜層:これは小胞の最も内側を形成し、様々なタンパク質が含まれる生体膜です。この層は、細胞外または他の細胞内部からの分子を含むことができます。
2. アダプタータンパク質の層:この層は脂質膜層の外側に位置し、小胞が正確な位置に物質を運ぶのを助ける役割を持っています。アダプタータンパク質は、特定の受容体や他の分子を認識し、それらをクラスリンコートの内部に引き込むことで、小胞の選択性と効率性を高めます。
3. クラスリンの外側の層:クラスリン層は小胞の最も外側を形成し、トリスケリオンの形をしたタンパク質が格子状に組み合わさることで、膜の曲げや小胞の切り離しを促進します。この層は、小胞が適切な形とサイズを維持するのに役立ちます。
アダプタータンパク質は脂質層とクラスリン層の両方と相互作用することで、小胞の形成とターゲット化の橋渡し役を果たします。この相互作用により、小胞は正確なターゲットに効率的に膜や分子を運ぶことができます。この複雑なプロセスは、細胞の機能と応答性を支える基礎となっています。
クラスリンでコーティングされた小胞の形成プロセスは、細胞内で非常に重要な役割を果たしています。まず、細胞膜の特定の部分にクラスリンとアダプタープロテイン2(AP-2)と呼ばれるタンパク質複合体が集まり、これによりコーティングされたピットが形成されます。このピットは、対応する受容体が結合した高分子を含む小胞へと進化します。
小胞の形成が進むにつれて、ダイナミンという細胞質タンパク質が重要な役割を担います。ダイナミンは小胞の縁を覆うように重合し、GTP(グアノシン三リン酸)の加水分解を利用してエネルギーを提供することで、小胞の封鎖を促進します。これにより、小胞は完全に形成され、細胞膜から切り離されます。
その後、このクラスリンでコーティングされた小胞は初期エンドソームと融合する能力を持ち、このプロセスは細胞内の物質輸送と分配の基本的な部分です。初期エンドソームが酸性になると、含まれている分子が受容体から分離し、細胞によって利用されるようになります。一方で、細胞受容体はエンドソーム内に留まり、細胞膜に戻されるか、または後期エンドソームに移動し、リソソームによる分解のプロセスに進むことになります。
このようにして、クラスリンとAP-2が形成する小胞は、細胞の栄養摂取やシグナル伝達、物質リサイクルのメカニズムに中心的な役割を果たしています。
クラスリンを介したエンドサイトーシスは、細胞の物質輸送メカニズムの中で最もよく研究されている形態の一つです。このプロセスは、特定の細胞膜領域でのクラスリンコートの形成を通じて、小胞を細胞内に取り込むために使用されます。
このエンドサイトーシス形式には、50種類以上の関連タンパク質が関与していると考えられています。これらのタンパク質には様々な役割がありますが、主には以下のような機能を担っています:
1. 受容体の認識とバインディング:特定の受容体やその他の分子を識別し、それらを小胞に取り込むための最初のステップとして機能します。
2. コート形成:クラスリンとアダプタータンパク質(例えばAP-2)が連携して、エンドサイトーシスに必要な小胞のコーティングと形成を支援します。
3. 小胞の脱出と運搬:ダイナミンのようなタンパク質がエネルギーを利用して小胞の切り離しを行い、エンドサイトーシスプロセスを完了します。
4. 小胞の融合と内容物の処理:形成された小胞が初期エンドソームと融合し、その内容物が細胞内で適切に処理されるためのプロセスです。
この広範囲にわたるタンパク質の複合体が連携して機能することにより、細胞は外部からの信号を受け取り、栄養素を取り込み、その他多くの重要な生物学的プロセスを効率的に行うことができます。クラスリンを介したエンドサイトーシスは、これらのプロセスを理解する上で非常に重要なモデルとされています。
クラスリンと有糸分裂
膜輸送は細胞の生命活動において重要な役割を果たしますが、その活動パターンは細胞の生活サイクルによって異なる場合があります。具体的に、クラスリンを介した膜輸送は、細胞が間期にある間に活発に行われます。間期は細胞周期の中で細胞が成長し、DNAを複製する期間です。この時期には多くの物質が細胞内外に輸送され、細胞の機能と維持に必要な要素が供給されます。
しかし、細胞が有糸分裂に入ると、クラスリンを介した膜輸送は急速に停止します。有糸分裂は細胞がその遺伝情報を正確に子細胞に分配するための過程であり、この間、細胞は膜輸送よりも染色体の分配に注力します。クラスリンの活動が停止することは、細胞がエネルギーと資源を分裂プロセスに集中させるための一環と考えられます。
膜輸送の停止は、テロフェイズ後期まで続きます。テロフェイズは有糸分裂の最終段階であり、ここで細胞質分裂が完成し、二つの新しい細胞が完全に形成されます。この段階でクラスリンを介した膜輸送が再開されることは、細胞が新しい生活サイクルに備えて通常の代謝活動を再開する準備が整ったことを示しています。
このような観察結果から、クラスリンが持つ機能が有糸分裂中に変化する可能性が示唆されています。つまり、クラスリンは膜輸送の調整だけでなく、細胞分裂のプロセス自体においても何らかの役割を果たしているかもしれません。このことは、クラスリンの機能と調整の仕方が細胞の状態に応じて異なる可能性を示しており、細胞の生物学的複雑さをさらに深く理解する手がかりとなります。
有糸分裂中にクラスリンの細胞内分布が変化することは、このタンパク質が細胞周期の異なる段階で異なる機能を持つ可能性を示しています。通常、間期にはクラスリンは細胞膜、エンドソーム、ゴルジ装置に集中し、これらの位置でクラスリンでコーティングされたピットや小胞の形成に関与しています。これは、細胞の通常の代謝活動や物質輸送におけるクラスリンの役割を反映しています。
有糸分裂が進行すると、クラスリンは細胞膜やエンドソームから離れて、紡錘体に移動することが観察されています。紡錘体は有糸分裂中に染色体を娘細胞に均等に分配するために必要な構造であり、クラスリンがこの部分に局在することは、紡錘体の構成要素として何らかの役割を果たしていることを示唆しています。この発見は、特に発達中のマウス胚において詳細に研究されており、クラスリンが細胞分裂プロセス自体に重要な影響を与えていることが示されています。
このような分布の変化は、クラスリンが細胞分裂中に新たな機能を持つ可能性を示唆しています。これにより、クラスリンが細胞の生活サイクルにおいて多様な役割を持ち、その機能が単に膜輸送に限定されないことが強調されます。クラスリンのこのような多機能性は、細胞生物学における重要な発見であり、将来的には新しい治療目標や細胞機能調節の手法としての応用が考えられます。
間期においてクラスリンは細胞質中の多くのクラスリンでコーティングされた構造(CCS)に分布しており、これは細胞内の物質輸送と分配に主に関与しています。しかし、細胞が有糸分裂のプロセスに入ると、クラスリンの役割と分布が顕著に変化します。
有糸分裂の初期段階であるプロフェーズに入ると、クラスリンは微小管と結合するようになります。この時、微小管は核膜に侵入し、細胞分裂に必要な構造の一部として機能します。クラスリンのこの微小管への結合は、紡錘体の形成と安定化に貢献している可能性があります。
さらに、細胞がメタフェーズとアナフェーズを迎えると、クラスリンは紡錘体の微小管に結合したまま、染色体の適切な分離と移動をサポートします。この段階でのクラスリンの働きは、細胞分裂の正確性を確保する上で重要です。
最終的にテロフェーズに至ると、細胞は分裂を終えてゴルジ装置の再構築を始めます。この段階でクラスリンは微小管から解離し、再び細胞質中での膜輸送に関わるクラスリンでコーティングされた構造へと移行します。このようにクラスリンは、細胞の生活サイクルの異なる段階で様々な役割を果たしており、その多様な機能は細胞の生理的な過程に深く組み込まれています。
分裂紡錘体におけるクラスリンの役割は、通常の細胞膜関連の膜輸送機能とは異なる特異的なものです。クラスリンは、細胞が有糸分裂に入ると、分裂紡錘体の微小管に密接に結合し、特に膜ではなく、微小管構造に関わっています。この結合は、クラスリンの重鎖(CHC)のN-末端ドメインを介して行われます。クラスリンが紡錘体の微小管と結合する主な場所は、染色体の動原体から細胞の赤道に向かう動原体繊維で、この場所でクラスリンは染色体の正確な位置決めと移動を支援しています。
クラスリンがこのように微小管に結合している間、動原体繊維の安定化に大きく寄与し、染色体をメタフェーズプレート(細胞の赤道)に正確に配置する役割を果たしています。CHCの機能が損なわれると、染色体の配置のズレや動原体繊維の不安定化が生じ、これが有糸分裂の過程において多くの問題を引き起こします。その結果、紡錘体チェックポイントの活性が持続し、有糸分裂が適切に進行しないため、分裂過程が遅延されることがあります。
このようにクラスリンは、その重要な構造的役割によって、分裂期の紡錘体の正常な機能を支え、細胞分裂の正確性を保証するためのキーとなるタンパク質として機能します。この発見は、クラスリンが細胞分裂において単なる膜輸送の要素以上の重要な役割を持つことを示しており、その機能の多様性と生物学的重要性を強調しています。
クラスリンの三量体構造、すなわちトリスケリオンとしても知られる構造は、その三つの「足」がそれぞれのN-末端ドメインを介して紡錘体微小管に結合することで、紡錘体繊維の安定化に寄与している可能性が高いと考えられています。この三量体の形状が微小管間の物理的なつながりを提供し、それによって微小管の構造がより安定し、有糸分裂中における染色体の正確な動きを支える役割を果たしているとされています。
紡錘体繊維内の微小管間には、いわゆる「管間ブリッジ」と呼ばれる構造が存在しており、これが微小管同士を連結していることが知られています。クラスリンがこのブリッジの一部を形成している可能性があるという仮説は、クラスリンの三量体構造が紡錘体繊維内の複数の微小管間に跨がり、これらを結びつける架橋として機能していることを示唆しています。これにより、紡錘体の全体的な構造の整合性と機能が保たれ、細胞分裂の過程での染色体の正確な分配が可能になるわけです。
このようにクラスリンが持つ構造的な特性と紡錘体との相互作用は、クラスリンが細胞分裂のメカニズムにどのように組み込まれているかを理解する上で非常に重要な情報を提供しています。この知見は、細胞生物学の領域においてクラスリンの機能と紡錘体の安定性に関する新たな視点を開くものであり、今後の研究の進展が期待されています。
クラスリン遺伝子
ヒトでは、クラスリン重鎖にはCHC17とCHC22という2つのアイソフォームが存在します。これらは似た構造を持ちながらも、異なる組織で発現し、特異的な生物学的機能を持っています。
● CHC17
CHC17は全身に広く分布するアイソフォームで、1,675アミノ酸から構成されています。このタンパク質は、細胞内の膜輸送と有糸分裂プロセスに広く関与しており、通常の細胞機能に不可欠です。CHC17はクラスリンでコーティングされた小胞の形成において中心的な役割を果たし、細胞内の物質の適切な輸送と分配を支援します。
● CHC22
CHC22は特に骨格筋や脂肪細胞で発現しており、1,640アミノ酸から構成されています。このアイソフォームは、インスリン応答性のGLUT4トランスポーターを含む特定の細胞内コンパートメントの形成に関与しています。GLUT4はグルコースの細胞内への取り込みを促進するため、CHC22の活動はインスリン感受性と直接的に関連しており、2型糖尿病患者における筋肉内のGLUT4コンパートメントの異常な拡大とも関連があります。
● CLTCL1
CLTCL1(クラスリンライトチェーンの一種)は、特に発達中のヒトの脳で重要な役割を果たします。このタンパク質は妊娠12~13週の間にその発現がピークに達し、幼少期に向かって減少します。CLTCL1は、神経堤細胞の発達や痛みや触覚を感知する神経細胞の形成に不可欠です。
これらのアイソフォームとタンパク質の特異的な機能は、クラスリンタンパク質が細胞生物学において持つ多様性と重要性を示しています。各アイソフォームは独自の生理的プロセスを支え、健康と病態の両方において重要な役割を果たしています。
CHC17とCHC22(またはCLTCL1)というクラスリン重鎖のアイソフォームは、それぞれ異なる遺伝子によってコードされていますが、アミノ酸レベルで高い類似性を持っています。具体的には、以下のようになります:
● CLTC遺伝子(CHC17)
CLTC遺伝子はヒトの17番染色体のq23.2領域に位置しており、この遺伝子からはCHC17タンパク質が産生されます。このタンパク質は全身の多くの組織で発現し、細胞内膜輸送と有糸分裂における重要な役割を果たします。CHC17はクラスリンでコーティングされた小胞の形成に中心的な役割を持ち、物質のセルラートラフィックにおいて基本的な機能を担っています。
● CLTCL1遺伝子(CHC22)
一方、CHC22はCLTCL1遺伝子によってコードされており、この遺伝子は22番染色体のq11.21領域に位置しています。CHC22タンパク質は主に骨格筋や脂肪細胞で発現しており、インスリン応答性のGLUT4コンパートメントの形成と機能に関与します。これは、特に代謝病態の研究や2型糖尿病治療の研究において重要なターゲットです。
これら二つのタンパク質はアミノ酸レベルで約85%の類似性を持っており、そのため、構造的および機能的な特性が部分的に共有されていますが、組織特異性と機能的な違いが存在します。この高い類似性にもかかわらず、彼らが担う生物学的役割はかなり異なっており、それぞれが特有の生理的および病理的プロセスに関与していることを示しています。
また、ヒトには2つのクラスリン軽鎖aおよびb(LCa、218残基、LCb、211残基)が存在するが、これらははるかに分岐している(アミノ酸の同一性は60%)。LCaとLCbは、9p13.3と5q35.2にある2つの別々の遺伝子CLTAとCLTBによってコードされている。両軽鎖には神経細胞特異的なスプライシングバリアントがあり、LCaには30残基、LCbには18残基のセグメントが挿入されている。LCaとLCbはともにCHC17と結合できるが、CHC22とは結合できない。
クラスリンと疾患
ヒトにはクラスリン軽鎖の二つのタイプ、LCaとLCbが存在し、それぞれ異なる遺伝子によってコードされています。これらの軽鎖はクラスリンの構造と機能において重要な役割を果たしますが、相互の間には明確な違いがあります。
● クラスリン軽鎖 LCa と LCb
– LCa: 218アミノ酸からなるLCaは、9p13.3に位置するCLTA遺伝子によってコードされます。
– LCb: 211アミノ酸からなるLCbは、5q35.2に位置するCLTB遺伝子によってコードされます。
アミノ酸レベルでの同一性は約60%とされており、これは彼らがクラスリンタンパク質の中でも分岐していることを示しています。つまり、機能的および構造的にはかなりの違いがあると考えられます。
● 神経細胞特異的なスプライシングバリアント
LCaとLCbは、神経細胞特異的なスプライシングバリアントを持ちます。これは神経細胞での特定の機能を果たすためのものと考えられています。
– LCaバリアントには30アミノ酸のセグメントが挿入されています。
– LCbバリアントには18アミノ酸のセグメントが挿入されています。
● CHC17およびCHC22との結合性
LCaとLCbはともにクラスリン重鎖の一般的な形態であるCHC17と結合する能力を持ちますが、CHC22とは結合しません。これは、CHC22が特定の組織で特異的な機能を持つことと関連している可能性があります。特に、CHC22が筋肉や脂肪細胞での特定のタスクに関与していることと、軽鎖がこれに結合しないという事実は、CHC22の機能的な特異性をさらに強調しています。
このように、クラスリン軽鎖はクラスリン重鎖と共に複雑な相互作用を通じて細胞内のさまざまな機能を果たしており、その生物学的役割は多岐にわたります。
クラスリンの細胞内シグナル伝達における役割
クラスリンと細胞膜受容体の相互作用
## クラスリンと細胞膜受容体の相互作用
クラスリンは細胞膜受容体との相互作用を通じて、細胞内への物質の取り込みに重要な役割を果たしています。このプロセスはクラスリン依存的エンドサイトーシス(CME)と呼ばれ、細胞膜上での受容体の集積や小胞の形成に関与しています。
● クラスリン依存的エンドサイトーシス
クラスリン依存的エンドサイトーシスは、細胞膜上の特定の受容体が外部のリガンドに結合した後、細胞内に取り込まれる過程です。このプロセスでは、クラスリンが細胞膜上で重合し、クラスリン被覆ピットを形成します。クラスリン被覆ピットは、細胞膜の特定の部分において、受容体やその他の分子が集積する場所であり、これらの分子はクラスリン被覆小胞として細胞内に取り込まれます[2][5].
● クラスリンと受容体の相互作用
クラスリンは直接細胞膜に結合するわけではなく、AP-2やepsinなどの分子群との間の分子間相互作用を介してクラスリン被覆ピット(CCP)へ集積します[1]. また、Gタンパク質共役型受容体(GPCR)と結合したアレスチンは、クラスリンと相互作用することが知られており、この相互作用は細胞膜上でのクラスリンの重合と関連しています[2][3].
● クラスリンの機能と細胞内シグナリング
クラスリンは細胞内シグナリング経路にも関与しており、受容体が刺激を受けた後に細胞内に移行する現象であるエンドサイトーシスにおいて、主にクラスリン被覆小胞を介して行われます[8]. このプロセスは、細胞の応答やシグナル伝達において重要な役割を果たしています。
● クラスリンの研究と応用
クラスリンと細胞膜受容体の相互作用に関する研究は、細胞の物質取り込みメカニズムの理解を深めるだけでなく、薬効評価や疾患治療における新たなアプローチの開発に寄与する可能性があります[3]. 例えば、mGluR3は統合失調症との関連が示唆されており、クラスリン依存的エンドサイトーシスの研究は、このような神経関連疾患の治療に役立つ可能性があります[3].
クラスリンと細胞膜受容体の相互作用は、細胞生物学における基本的なプロセスであり、細胞の機能と疾患の理解において重要な研究分野です。
クラスリン依存的な活性化因子の機構
クラスリン依存的な活性化因子の機構について解説します。クラスリン依存的なエンドサイトーシス(CME)は、細胞膜の特定の部分が内側にくぼみ、細胞内に小胞を形成する過程です。この過程は、細胞が外部からのシグナルや栄養素を取り込むために重要です。クラスリン依存的な活性化因子は、このエンドサイトーシス過程を調節し、特定の分子や受容体の細胞内への取り込みを促進します。
● クラスリン依存的エンドサイトーシスの概要
クラスリン依存的エンドサイトーシスは、以下の主要なステップで構成されます:
1. 膜の窪みの形成:細胞膜上にクラスリンと呼ばれるタンパク質が集積し、膜の窪みを形成します。
2. 積み荷の集積:特定の受容体や分子が、アダプタータンパク質を介してクラスリン被覆ピットに集められます。
3. 膜の分断:ダイナミンというタンパク質が、クラスリン被覆小胞の膜を分断し、細胞内に取り込みます。
4. クラスリン被覆の脱落:細胞内に取り込まれた後、クラスリン被覆は脱落し、取り込まれた分子が細胞内で処理されます[2][3]。
● クラスリン依存的な活性化因子
クラスリン依存的なエンドサイトーシスを調節する活性化因子には、以下のようなものがあります:
– AP2アダプタータンパク質:受容体にリガンドが結合すると、AP2アダプタータンパク質が細胞内で活性化され、クラスリン被覆ピットの形成を促進します[1]。
– ダイナミン:クラスリン被覆小胞が細胞膜から分断される過程を司ります。ダイナミンはGTP分解酵素活性を持ち、このエネルギーを利用して膜の分断を行います[3]。
– Hsc70:クラスリン被覆の脱落に関与する分子シャペロンです。クラスリン被覆小胞が形質膜から分断された後、Hsc70はクラスリン被覆の脱落を促進します[3]。
● エンドサイトーシスの重要性
クラスリン依存的なエンドサイトーシスは、細胞が外部からのシグナルを受け取り、内部で処理するための重要なメカニズムです。この過程を通じて、細胞は栄養素を取り込んだり、細胞表面の受容体を調節したりすることができます。また、ウイルスや細菌などの病原体が細胞内に侵入する際にも利用されることがあります[6]。
クラスリン依存的なエンドサイトーシスの調節機構の理解は、細胞生物学だけでなく、医学や薬学においても重要な意味を持ちます。特定の病原体の侵入経路をブロックすることや、特定の薬物の細胞内への効率的な送達方法の開発など、多くの応用が期待されています。
クラスリン研究の新たな展開
2014年以降のクラスリンに関する科学論文の分析
## 2014年以降のクラスリンに関する科学論文の分析
クラスリンは細胞内輸送において重要な役割を果たすタンパク質であり、エンドサイトーシスや膜交通の過程で小胞の形成に関与しています。2014年以降に発表された科学論文を分析することで、クラスリンに関する研究の進展と現在の理解を深めることができます。
● クラスリン依存性エンドサイトーシスの機構
クラスリン依存性エンドサイトーシスは、細胞が物質を取り込む主要な経路の一つです。この過程では、クラスリンが細胞膜上で格子状に重合し、小胞を形成することで物質の取り込みが行われます。2014年以降の研究では、クラスリン重合過程の進行を担うタンパク質群の相互作用の構造的基盤が明らかにされています[10]。また、クラスリン被覆小胞の形成と細胞内への輸送がどのような分子機構で起こるのかについても研究が進んでいます[16]。
● クラスリンと細胞膜マイクロドメインの関係
細胞膜マイクロドメインは、細胞のシグナル伝達や物質輸送において重要な役割を果たします。クラスリンはこれらのマイクロドメインと関連しており、質量分析による細胞膜マイクロドメイン脂質の定量的解析法が開発されています[19]。このような技術の進歩により、クラスリンと細胞膜マイクロドメインの相互作用に関する理解が深まっています。
● クラスリン非依存性エンドサイトーシス
クラスリン非依存性エンドサイトーシスは、クラスリンやカベオラ依存性エンドサイトーシスとは異なる取り込み様式をとります。この過程では被覆小胞を形成せずに物質を取り込むことが特徴であり、Ras-PI3Kシグナルによるエンドサイトーシスとウイルス粒子取り込みの関係が研究されています[20]。
● クラスリンと疾患
クラスリンは疾患の発生にも関与しており、特に神経変性疾患やがんなどの病態において重要な役割を果たしていることが示唆されています。クラスリンの機能異常はこれらの疾患の発症に寄与する可能性があり、治療法の開発につながる研究が期待されています[16]。
● 結論
2014年以降のクラスリンに関する科学論文の分析から、クラスリン依存性および非依存性エンドサイトーシスのメカニズム、細胞膜マイクロドメインとの関係、疾患との関連性など、多岐にわたる研究が進展していることがわかります。これらの研究は、細胞生物学の基本的な理解を深めるだけでなく、疾患治療への応用にも大きな影響を与える可能性があります。クラスリンに関する研究は、今後も生命科学の重要な分野として注目されるでしょう。
クラスリンと細胞機能におけるその重要性
## クラスリンと細胞機能におけるその重要性
クラスリンは細胞膜におけるさまざまな輸送やシグナル伝達に重要な役割を担っており、細胞内輸送における多彩な役割が明らかになりつつある[3]。クラスリンは、細胞膜の微小な陥没に始まり、膜の変形、切断といったプロセスを経てエンドサイトーシスが行われる際に、細胞膜の形態変化に関与している[1]。エンドサイトーシスは、細胞内外のシグナル伝達や細胞の環境応答などの細胞機能に重要である[1]。
クラスリン分子は、トリスケリオンと呼ばれる三脚構造を形成する3つの軽鎖と3つの重鎖から成っており、この構造が被覆小胞の被覆の骨格となる[2]。細胞膜からのクラスリン被覆小胞の形成は、真核生物のさまざまな系統に共通する膜交通の基本的なプロセスの一つであり、細胞内への輸送に重要な役割を果たしている[5]。
クラスリンは、細胞膜からエンドサイトされた膜や、トランスゴルジネットワーク(TGN)とエンドソームの間を移動する膜のコーティングに関与している。また、クラスリンは有糸分裂時に紡錘体のキネトコア繊維に局在することも示されており、細胞分裂においても重要な役割を果たしている。
クラスリンが関与する遺伝子融合は、多くのヒトの癌で見られる。例えば、クラスリン重鎖と未分化リンパ腫キナーゼ(CHC-ALK)の融合は、非ホジキンリンパ腫(未分化大細胞リンパ腫)や炎症性筋線維芽細胞性腫瘍で報告されている。
クラスリンは、クラスリン被覆小胞を形成して進行するエンドサイトーシスに中心的な役割を果たしている蛋白質であり、エンドサイトーシス以外の細胞応答にも関わっていることが推定されている[9]。クラスリンのエンドサイトーシスとは関係しない細胞内シグナリング経路においても、クラスリンが重要な役割を果たしている可能性がある[9]。
クラスリン依存的エンドサイトーシスは、神経伝達、シグナル伝達などの多くの細胞膜活性の制御に関わっており、クラスリン被覆小胞形成は核形成、カーゴ選択、被覆構築などのプロセスを含む[8]。これらのプロセスは、細胞の機能を維持し、適切な反応を可能にするために不可欠である。
総じて、クラスリンは細胞の基本的な機能を支えるために不可欠なタンパク質であり、細胞内輸送、シグナル伝達、細胞分裂など、生命維持に必要な多くのプロセスにおいて中心的な役割を果たしている。
- 参照・引用
-
[1] repository.kulib.kyoto-u.ac.jp/dspace/bitstream/2433/225752/5/dseik00369.pdf
[2] www.emf-portal.org/ja/glossary/3550
[3] www.natureasia.com/ja-jp/nature/highlights/18586
[4] leading.lifesciencedb.jp/5-e008
[5] www.nibb.ac.jp/press/2020/09/22.html
[7] bsd.neuroinf.jp/wiki/%E3%82%A2%E3%83%80%E3%83%97%E3%82%BF%E3%83%BC%E3%82%BF%E3%83%B3%E3%83%91%E3%82%AF%E8%B3%AA%E8%A4%87%E5%90%88%E4%BD%93
[8] jglobal.jst.go.jp/detail?JGLOBAL_ID=201102222673946715
[9] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-18659024/
クラスリンとその関連物質の英語・日本語文献の紹介
提供されたソースを基に、クラスリン関連の科学技術情報についての概要を日本語で説明します。
● クラスリン依存性エンドサイトーシスの基本概念
クラスリン依存性エンドサイトーシス(CME)は、細胞が細胞外の物質を取り込む主要なメカニズムの一つです。この過程では、クラスリンというタンパク質が細胞膜上で格子状に重合し、細胞膜を内側に押し込んで小胞を形成します。この小胞は細胞内に取り込まれ、細胞外からの物質を細胞内に運びます[4]。
● クラスリンの構造と機能
クラスリンは、191kDaの重鎖と30kDa弱の軽鎖からなり、トリスケリオン(三脚巴構造)を形成します。この構造は、細胞膜をくびれさせて小胞を形成するのに適しています[7]。クラスリンはエンドサイトーシス以外にも、細胞内シグナリング経路に関与することが示唆されています[7]。
● エンドサイトーシスの分子機構
クラスリン依存性エンドサイトーシスには、複数のタンパク質が関与しています。例えば、FBP17はエンドサイトーシスの膜陥入ステップに関与し[1]、Eps15やAP-2複合体はクラスリン重合過程を進行させる鍵となる分子です[4]。また、アクチン繊維の集合やダイナミンの活動も、小胞の形成と輸送に重要な役割を果たします[2]。
● エンドサイトーシスの生理機能
クラスリン依存性エンドサイトーシスは、細胞が栄養素を取り込むだけでなく、細胞表面の受容体を調節し、シグナル伝達を制御するためにも重要です。この過程は、神経伝達やシグナル伝達など、多くの細胞膜活性の制御に関わっています[5]。
● 研究の進展と応用
クラスリン依存性エンドサイトーシスの詳細なメカニズムの解明は、がんや感染症のメカニズム解明につながる可能性があります[3]。また、この過程をターゲットにした創薬の基礎となる成果も期待されています[4]。
以上の情報は、クラスリン依存性エンドサイトーシスに関する基本的な概念、構造と機能、分子機構、生理機能、および研究の進展と応用についての概要を提供します。
- 参照・引用
-
[1] www.riken.jp/medialibrary/riken/pr/press/2007/20070519_1/20070519_1.pdf
[2] repository.kulib.kyoto-u.ac.jp/dspace/bitstream/2433/225752/5/dseik00369.pdf
[3] www.tus.ac.jp/today/archive/20220824_8725.html
[4] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-17K07309/
[5] jglobal.jst.go.jp/detail?JGLOBAL_ID=201102222673946715
[6] www.astellas-foundation.or.jp/pdf/research/21/h21_43_toshima.pdf
[7] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-18659024/









