目次
クロマチンの構造とその科学的意義について解説します。遺伝子の発現制御におけるクロマチンの役割、遺伝子アクセシビリティへの影響、そして現代科学におけるその研究動向を明らかにします。」
第1章 クロマチンとは
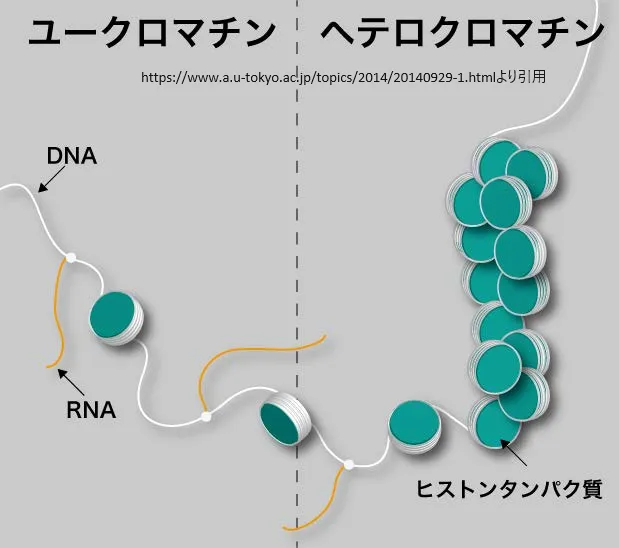
クロマチンの基本構造とは何か
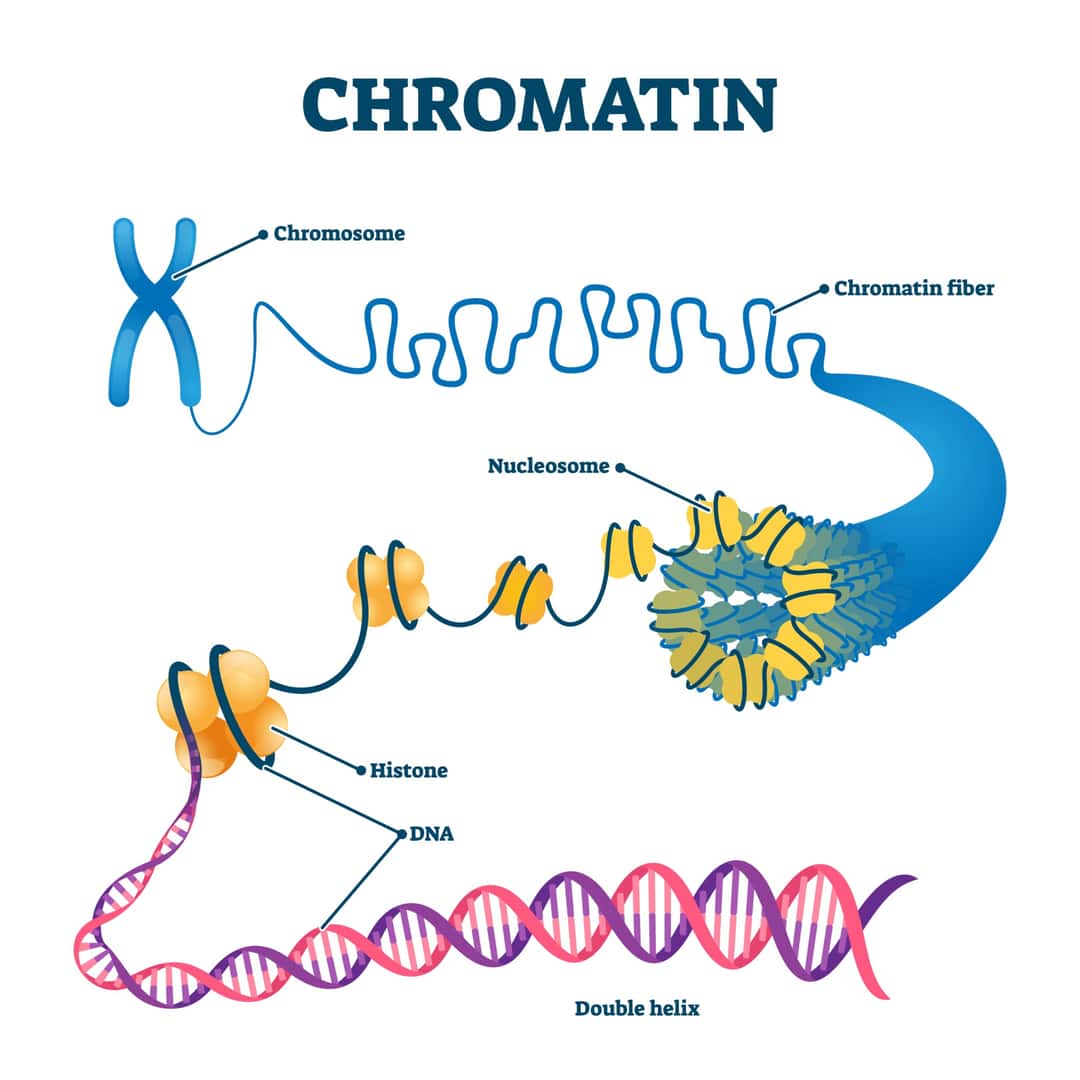
クロマチンの基本構造は、ヌクレオソームをその基本単位としています。ヌクレオソームは、DNAがヒストンタンパク質8量体に約150塩基対巻きついた構造であり、この形をダイナミックに変えながら遺伝子の発現制御を行っています[1]。具体的には、4種類のヒストンタンパク質に146もしくは147塩基対のDNAが巻き付いており、ヌクレオソームとヌクレオソームをつなぐ間のDNAをリンカーDNAと呼びます[3]。また、クロマチンは、ヒストンとDNAで構成されており、147塩基対のDNAが8つのコアヒストンに巻きつくことでヌクレオソームが形成されます[5]。このヌクレオソーム構造が、クロマチンを構築するうえで最も基本となる構造であり、これを直径約10 μmの核に収納するための構造がクロマチンであるとされています[7]。
ヘテロクロマチンとユークロマチンは、クロマチンの二つの主要な形態であり、それぞれ異なる機能と特性を持っています。
●ヘテロクロマチン
ヘテロクロマチンは、クロマチンが高度に凝縮された状態を指します。この形態のクロマチンは、染色体の特定の領域、例えばセントロメアやテロメアなどに存在し、遺伝子の発現が抑制されていることが特徴です。ヘテロクロマチンは、構成的ヘテロクロマチンと条件的ヘテロクロマチンの二つに大別されます。構成的ヘテロクロマチンは、細胞の種類に関わらず常に凝縮された状態にあり、遺伝子発現が半永久的に抑制されています。一方、条件的ヘテロクロマチンは、特定の発生段階や細胞の種類に応じて凝縮され、遺伝子の発現が抑制されることがあります。
●ユークロマチン
ユークロマチンは、クロマチンが比較的緩やかに構造化されている状態を指し、遺伝子が多く含まれており、転写が頻繁に行われる領域です。ユークロマチンは、遺伝情報の読み出しが活発に行われるため、細胞の機能発現や応答に重要な役割を果たしています。
●機能的な違い
ヘテロクロマチンとユークロマチンの主な違いは、遺伝子の発現活性にあります。ヘテロクロマチンは遺伝子の発現を抑制することで、ゲノムの安定性を保ち、不必要な遺伝子の発現を防ぎます。これに対して、ユークロマチンは遺伝子の発現が活発であり、細胞の特定の機能を果たすために必要なタンパク質の合成に寄与しています。このように、ヘテロクロマチンとユークロマチンは、細胞内で異なる役割を担っており、細胞の遺伝子発現パターンと機能の調節に重要な役割を果たしています。
- 参照・引用
-
[1] www.nibb.ac.jp/potentia/nucleosome/content.html
[2] www.riken.jp/press/2022/20220819_1/index.html
[3] www.wakayama-med.ac.jp/med/lasbiology1/morita/img/file2.pdf
[4] www.brh.co.jp/publication/journal/046/research_21
[5] www.abcam.co.jp/epigenetics/chromatin-accessibility-and-architecture-4
[6] www.jstage.jst.go.jp/article/biophys1961/19/2/19_2_100/_pdf/-char/ja
[7] ja.wikipedia.org/wiki/%E3%82%AF%E3%83%AD%E3%83%9E%E3%83%81%E3%83%B3
クロマチンの生化学的機能
クロマチンは、DNAとヒストンタンパク質から構成される複合体であり、真核生物の細胞核内に存在します。その主な生化学的機能は、DNAをコンパクトに収納し、遺伝情報の安定性とアクセシビリティを調節することにあります。クロマチン構造は、遺伝子の発現、DNAの複製、修復、および組換えなど、DNA上で起きる様々な生化学的プロセスを制御する重要な役割を果たしています。
● クロマチンの構造と機能
クロマチンの基本単位はヌクレオソームで、これは4種類のヒストンタンパク質(H2A, H2B, H3, H4)各2分子からなるヒストン八量体に約150塩基対のDNAが巻きついた構造体です[1]。ヌクレオソームは、DNAをコンパクトに収納し、遺伝情報の物理的保護を提供するとともに、遺伝子の発現を調節するためのプラットフォームを提供します。
● 遺伝子の発現調節
クロマチンは、遺伝子の発現を調節するために、その構造を動的に変化させます。ユークロマチンは転写が活発に行われている領域で、DNAが比較的緩く巻かれており、転写因子がアクセスしやすい状態にあります。一方、ヘテロクロマチンは転写が抑制されている領域で、DNAが密に巻かれており、転写因子のアクセスが制限されます[1]。
● エピジェネティックな調節
クロマチンは、ヒストンの化学修飾やDNAメチル化によっても調節されます。これらのエピジェネティックな修飾は、遺伝子の発現を調節するための追加のメカニズムを提供し、細胞の特定の発達段階や環境条件に応じて遺伝子発現パターンを変化させることができます[1][3]。
● クロマチンリモデリング
クロマチンリモデリングは、ヌクレオソームの位置を変化させることによって、特定の遺伝子領域のアクセシビリティを調節するプロセスです。これにより、転写因子が遺伝子のプロモーター領域にアクセスしやすくなったり、逆にアクセスが制限されたりします。クロマチンリモデリングは、リモデリング因子と呼ばれる特定のタンパク質によって触媒されます[3]。
● 結論
クロマチンの生化学的機能は、遺伝情報の物理的保護、遺伝子の発現調節、および細胞の特定の発達段階や環境条件に応じた遺伝子発現パターンの調節に重要です。クロマチン構造の動的な変化は、生命現象を支える基本的なメカニズムの一つであり、エピジェネティックな調節を通じて遺伝子の発現を精密に制御しています[1][3]。
第2章 クロマチンのダイナミクスと遺伝子の発現
クロマチンの再構成と遺伝子アクセシビリティ
クロマチンの再構成と遺伝子アクセシビリティに関する研究は、遺伝子の発現制御メカニズムを理解する上で重要な役割を果たしています。クロマチンは、DNAとヒストンタンパク質から構成される複合体であり、その構造の変化は遺伝子のアクセシビリティ、すなわち遺伝子が転写因子やその他の調節因子によって認識されやすくなるかどうかに直接影響を与えます。
● クロマチンの再構成
クロマチンの再構成は、ヌクレオソームの位置の変化やヒストン修飾の変化を含むプロセスです。これにより、クロマチンの構造が緩んだり(リラクゼーション)、または凝集したり(コンデンセーション)します。クロマチンのリラクゼーションは、遺伝子のプロモーターやエンハンサー領域が転写因子によってアクセスしやすくなり、結果として遺伝子の発現が促進されることがあります。一方、クロマチンの凝集は遺伝子のアクセシビリティを低下させ、遺伝子の発現を抑制することがあります[1][2][3][4][5][6][7][8][9][10][11]。
● 遺伝子アクセシビリティ
遺伝子アクセシビリティは、遺伝子がどの程度転写因子やその他の調節因子によってアクセス可能かを示します。クロマチンの再構成によって遺伝子のアクセシビリティが変化すると、遺伝子の発現パターンに影響を与え、細胞の機能や運命を決定することがあります。例えば、特定の発達段階や細胞応答において、特定の遺伝子群のアクセシビリティが増加し、それに伴ってこれらの遺伝子の発現が促進されることがあります[1][2][3][4][5][6][7][8][9][10][11]。
● 研究の進展
近年の研究では、クロマチンアクセシビリティの変化を詳細に解析するための新しい技術が開発されています。例えば、ATAC-seq(Assay for Transposase-Accessible Chromatin with high-throughput sequencing)は、オープンクロマチン領域を特定し、遺伝子アクセシビリティの変化をゲノムワイドで解析するために用いられます[8]。このような技術の進展により、クロマチンの再構成と遺伝子アクセシビリティの関係についての理解が深まり、遺伝子発現制御の新たなメカニズムが明らかになっています。
クロマチンの再構成と遺伝子アクセシビリティの研究は、遺伝子発現の調節機構を理解する上で不可欠であり、がんや遺伝性疾患などの疾患メカニズムの解明にも寄与しています。
- 参照・引用
-
[1] kaken.nii.ac.jp/ja/file/KAKENHI-AREA-7003/7003_chukan_hyoka_hokoku_ja.pdf
[2] www.titech.ac.jp/news/2020/048378
[3] www.riken.jp/press/2022/20220819_1/index.html
[4] www.amed.go.jp/news/release_20220610.html
[5] www.jstage.jst.go.jp/article/biophys/39/6/39_6_376/_pdf
[6] jglobal.jst.go.jp/detail?JGLOBAL_ID=201502212016650940
[7] www.abcam.co.jp/epigenetics/chromatin-accessibility-and-architecture-4
[8] diagenode.co.jp/techs-used-to-study-epigenetics/atac-seq
[9] www.abcam.co.jp/epigenetics/histone-modifications-ja
[10] kaken.nii.ac.jp/ja/file/KAKENHI-AREA-3506/3506_kenkyu_seika_hokoku_ja.pdf
[11] www.ims.u-tokyo.ac.jp/imsut/jp/about/press/page_00169.html
クロマチン改変と遺伝子発現の調節
クロマチンは、DNAとヒストンタンパク質から構成される複合体であり、遺伝子の発現を調節する重要な役割を果たしています。遺伝子発現の調節には、クロマチンの構造変化が深く関与しており、これらの変化はエピジェネティックなメカニズムによって制御されています。
● クロマチンの基本構造
クロマチンの基本単位はヌクレオソームであり、ヒストンタンパク質8量体にDNAが約150塩基対巻きついた構造をしています[1]。ヌクレオソームはさらに数珠状に連なり、クロマチンと呼ばれる高次構造を形成します。この構造は、遺伝子のアクセス可能性を調節し、遺伝子発現のオン・オフを制御するために重要です。
● エピジェネティックな調節機構
エピジェネティクスは、DNAの塩基配列に依存しない遺伝子の調節機構を指し、DNAのメチル化やヒストンのメチル化/アセチル化などの化学修飾が含まれます[2]。これらの修飾は、特定の遺伝子領域に可逆的に付加され、遺伝子発現の制御に寄与します。
● クロマチンリモデリング
クロマチンの構造変化を引き起こす因子をリモデリング因子と呼び、エピジェネティクスの制御に関わります[2]。リモデリング因子は、ヌクレオソームの位置を変えたり、ヌクレオソームを一時的に解体することで、遺伝子の発現を可能にするか、または抑制します。
● ヒストン修飾酵素
ヒストン修飾酵素は、ヒストンタンパク質の化学修飾を触媒する酵素で、アセチル化やメチル化などの修飾を担います[2]。これらの修飾は、クロマチンのアクセシビリティを変化させ、遺伝子発現に影響を与えます。
● クロマチン構造と遺伝子発現の関係
クロマチン構造は、遺伝子発現と密接に関連しています。例えば、ヌクレオソームが密集している領域は一般的に遺伝子発現が抑制される傾向にあり、逆にヌクレオソームが緩んでいる領域では遺伝子が活性化されやすいです[3]。
● 疾患とクロマチン構造
クロマチン構造の異常は、疾患の発生にも関連しています。例えば、がんの発生や進展には、エピジェネティックな変化が深く関わっており、ノンコーディングRNAやヒストンのエピジェネティックな機能が注目されています[4]。
● 研究の進展
クロマチン構造と遺伝子発現の関係についての理解は、生命科学の多くの分野で重要な研究テーマとなっています。特に、RNAポリメラーゼIIがヌクレオソームを一時的に解体して遺伝子の転写を行うメカニズムの解明は、遺伝子発現とクロマチン構造の維持がどのように両立しているのかという生物学上の大きな謎に答えるものです[2]。
クロマチンのダイナミックな変化を理解することは、遺伝子発現の精密な制御メカニズムを解き明かし、疾患メカニズムの理解や新たな治療法の開発につながる可能性があります。
第3章 クロマチンの研究手法
現代のクロマチン研究で使用される技術
現代のクロマチン研究では、遺伝子のオン・オフを調節するクロマチン構造の謎を解明するために、多様な先端技術が使用されています。これらの技術は、DNAやRNAのダイナミックな変化を可視化し、病気の診断や治療法の開発に貢献する可能性を秘めています。
● クロマチン構造の可視化技術
– クライオ電子顕微鏡: ゲノムDNAがどのように折り畳まれているかを「生きた状態」に近い細胞観察で明らかにする技術です。これにより、ゲノムDNAが規則的な30nmクロマチン線維ではなく、ヌクレオソーム線維の不規則な折り畳みとして存在し、絶えず動いていることが示されました[3]。
– X線散乱解析: 溶液中の非結晶物体の構造解析が可能な技術で、クロマチン構造の詳細な解析に利用されます[3]。
● エピゲノム解析技術
– ChIL-seq: 高感度なエピゲノム解析手法で、遺伝子発現を司る分子の移動度を評価する統計モデルと組み合わせて、埋もれた幹細胞の活性化情報を検出することができます[4]。
● エピゲノム操作技術
– エピゲノム操作技術の開発: 新規のエピゲノム操作技術の開発が進められており、特許化に向けた動きもある。これらの技術は、生殖細胞のエピゲノムダイナミクスとその制御に関する研究に貢献しています[2]。
● イメージング技術
– オープンクロマチン構造をイメージングする技術: クロマチン構造の開放状態を可視化する技術の開発が進められています。これにより、クロマチン構造の動態をより詳細に理解することが可能になります[6]。
これらの技術は、クロマチン構造の理解を深め、遺伝子発現の制御メカニズムの解明に貢献しています。また、iPS細胞の研究や再生医療への応用など、医学分野での利用が期待されています[1]。
クロマチン研究のための実験的アプローチ
クロマチン研究における実験的アプローチは、クロマチンの構造と機能を理解するために不可欠です。クロマチンはDNAとヒストンタンパク質から構成され、遺伝子の発現調節に重要な役割を果たしています。以下に、クロマチン研究における主要な実験的アプローチを紹介します。
● クロマチン免疫沈降法(ChIP)
クロマチン免疫沈降法(ChIP)は、特定のタンパク質や修飾されたヒストンが結合しているDNA領域を同定するために広く用いられています。この方法では、まずDNAとタンパク質を架橋剤で化学的に固定し、その後、超音波でDNAを断片化します。特定の抗体を用いてターゲットタンパク質-DNA複合体を免疫沈降し、最終的にDNAを精製して解析します。この技術により、特定のタンパク質がゲノム上のどの位置に結合しているかを特定できます[18]。
● ATAC-seq
ATAC-seq(Assay for Transposase-Accessible Chromatin with high-throughput sequencing)は、クロマチンのアクセシビリティーをゲノムワイドで解析する手法です。この技術では、Tn5トランスポゼースを用いてアクセス可能なクロマチン領域にシーケンスアダプターを挿入し、その後、高スループットシーケンシングを行います。ATAC-seqにより、オープンクロマチン領域や転写因子の結合サイトなど、遺伝子発現に関与する重要な領域を同定できます[16]。
● Hi-C
Hi-Cは、クロマチンの3次元構造を解析するための手法です。この技術では、架橋剤で固定されたクロマチンを制限酵素で切断し、DNA末端を接着してリゲーションします。これにより、空間的に近接しているが、ゲノム上では離れた位置にあるDNA領域間の相互作用を検出できます。Hi-Cによる解析は、クロマチン構造が遺伝子発現や細胞の機能にどのように影響を与えるかを理解するのに役立ちます。
● ヌクレオソーム位置決定
ヌクレオソームの位置決定は、ヌクレオソームがゲノム上でどのように配置されているかを解析するために用いられます。MNase-seq(Micrococcal Nuclease digestion followed by sequencing)は、ミクロコッカルヌクレアーゼを用いてヌクレオソームに保護されていないDNAを消化し、残ったヌクレオソーム保護DNAのシーケンスを決定することで、ヌクレオソームの位置をマッピングします[6]。
これらの実験的アプローチは、クロマチンの構造と機能に関する包括的な理解を深めるために、互いに補完的に使用されます。クロマチン研究は、遺伝子発現の調節機構、細胞のアイデンティティーの維持、さらには疾患の発生メカニズムの解明に不可欠な分野です。
第4章 クロマチンの生物学的重要性
クロマチンと疾病の関連性
クロマチンは、DNAとヒストンタンパク質から構成される複合体であり、遺伝子の発現調節に重要な役割を果たしています。クロマチンの構造や修飾の異常は、多くの疾患の発症に関与していることが知られています。
● クロマチン構造の異常と疾患
クロマチン構造の異常は、遺伝子の発現パターンを変化させ、細胞の機能不全や疾患の発症につながります。例えば、ヘテロクロマチンの形成異常は、がんや感染症などの原因となることが示唆されています[18]。また、クロマチンリモデラーの変異は、様々ながんで見つかり、がん抑制因子としての役割があることが分かっています[20]。
● エピジェネティクスと疾患
エピジェネティクスは、DNAの塩基配列に変化を加えずに遺伝子の発現を制御するメカニズムです。DNAメチル化やヒストン修飾などのエピジェネティックな変化は、神経変性疾患、糖尿病、がんなど多くの疾患と関連しています[13][14][15]。特に、ヒストンH3の9番目のリジン(H3K9)のメチル化は、クロマチンを閉鎖型にし、遺伝子の転写を抑制することで、糖尿病の治療に用いられるPPARγの活性化剤の標的となっています[19]。
● クロマチンとがん
クロマチンのダイナミックな動きを抑制することで、DNA修復におけるクロマチンの動きを阻害し、がん細胞の増殖を抑制する新たな治療法の開発が期待されています[16]。また、セントロメア以外の染色体領域にCENP-Aの異所的局在がみられることががん細胞で報告されており、染色体の不安定化とがん化との関係が注目されています[20]。
● 結論
クロマチンの構造や修飾の異常は、遺伝子の発現調節に影響を与え、多くの疾患の発症に関与しています。エピジェネティクスの研究進展により、クロマチン関連の疾患メカニズムの理解が深まり、新たな治療法の開発につながる可能性があります。
- 参照・引用
-
[13] www.cellsignal.jp/science-resources/hallmarks-of-ndg/hallmarks-altered-epigenetics
[14] jsn.or.jp/journal/document/59_2/058-064.pdf
[15] www.secomzaidan.jp/ippan/interview/medical/ichiyanagi/inta1.html
[16] www.kyoto-u.ac.jp/ja/research-news/2016-03-24-1
[17] www.jstage.jst.go.jp/article/geriatrics/47/1/47_1_44/_pdf/-char/ja
[18] www.nibb.ac.jp/press/2018/01/11.html
[19] www.mm.rcast.u-tokyo.ac.jp/research/research_02.html
[20] www.hokudai.ac.jp/news/2022/10/post-1108.html
クロマチンの構造と病態生理
クロマチンは、真核生物の細胞核内に存在するDNAとタンパク質からなる構造であり、遺伝子の発現制御に重要な役割を果たしています。クロマチンの基本単位はヌクレオソームで、これはヒストンタンパク質のオクタマー(8個のヒストン分子からなる複合体)にDNAが巻きついた構造をしています。ヌクレオソームはさらに高次の構造を形成し、クロマチン線維を作り出します。このクロマチン構造の動的な変化は、遺伝子の発現を制御する上で重要な役割を果たしています[19]。
クロマチン構造の変化は、エピジェネティックな遺伝子機能の制御の基盤となります。ヒストン修飾(メチル化、アセチル化など)やDNAのメチル化は、クロマチン構造を変化させ、遺伝子の発現を制御します。これらの修飾は、特定のタンパク質によって認識され、遺伝子のオン・オフを制御することで、細胞の運命や分化を決定します[6][11]。
クロマチン構造の異常は、多くの病態生理に関与しています。例えば、クロマチン構造の乱れは、がんや神経変性疾患などの発症につながることが知られています。特に、ヒストン修飾酵素の異常やヒストン異常、ヒストン発現量の異常など、エピジェネティックな破綻は、クロマチンの異常を引き起こし、病気の原因となることが示されています[12]。
クロマチンリモデリングの異常もまた、腫瘍の発生に関与しています。クロマチンリモデリング複合体は、ヌクレオソームの位置を変化させることで、DNAへのアクセスを調節し、遺伝子の発現を制御します。このリモデリング複合体の構成要素の変異や機能不全は、腫瘍の発生につながることが知られています[16]。
病態進行過程におけるクロマチン構造の動態変化の解明は、疾患の理解を深めるだけでなく、新たな治療標的の発見にもつながります。特に、エピジェネティックな変化をターゲットとした治療法の開発は、がん治療などで大きな期待が寄せられています[15]。
以上のように、クロマチン構造とその動的な変化は、細胞の正常な機能維持に不可欠であり、その異常は多様な病態生理に深く関与しています。クロマチン構造の詳細な解析と理解は、疾患のメカニズムの解明や新たな治療法の開発に不可欠です[1][2][6][11][12][15][16][19]。
- 参照・引用
-
[6] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2017.890441/data/index.html
[7] www.riken.jp/press/2022/20220819_1/index.html
[8] www.nsc.nagoya-cu.ac.jp/~jnakayam/_src/sc743/pubj04.pdf
[9] www.yokohama-cu.ac.jp/news/2020/202008nishimura_pnas.html
[10] www.jrias.or.jp/books/pdf/201403_TENBO_TAKATA_MAESHIMA.pdf
[11] www.abcam.co.jp/epigenetics/chromatin-accessibility-and-architecture-4
[12] www.amed.go.jp/pr/amedsympo2019_0207.html
[13] www.kango-roo.com/word/21210
[14] www.nsc.nagoya-cu.ac.jp/~jnakayam/_src/sc733/pubj13.pdf
[15] kaken.nii.ac.jp/ja/file/KAKENHI-AREA-3506/3506_kenkyu_seika_hokoku_ja.pdf
[16] www.f.kpu-m.ac.jp/k/jkpum/pdf/124/124-12/kuwahara12412.pdf
第5章 クロマチンの将来の研究方向
クロマチン研究の新たな展望
クロマチン研究は、遺伝子の発現制御や細胞の運命決定において中心的な役割を果たしています。近年の研究進展により、クロマチンの構造と機能に関する理解が深まりつつあります。ここでは、最新の研究成果を基に、クロマチン研究の新たな展望について概説します。
● クロマチンの構造解析
クロマチンは、DNAとヒストンタンパク質から構成される複合体であり、遺伝情報のアクセス制御に重要な役割を果たしています。東京大学定量生命科学研究所の胡桃坂仁志教授は、DNAの折りたたみ構造と遺伝子発現の相関を解明するために、クロマチンを形成するヌクレオソームの立体構造研究を推進しています[2]。この研究は、クロマチン構造の安定性と機能発現の関係性を明らかにし、クロマチン研究をリードしています。
● エピジェノムの制御
理化学研究所の共同研究グループは、細胞の機能発揮に関わるエピゲノムの化学修飾が遺伝子の転写に与える影響を定量化する方程式を導出しました[9]。この研究は、エピジェネティクスの分子機構の動的理解と今後の発展に貢献するものであり、クロマチン構造の動的な制御とその機能に新たな光を当てています。
● ゲノム異常獲得機構の解明
国立がん研究センターの研究チームは、正常細胞がゲノム異常を獲得するメカニズムを明らかにしました[3]。この研究成果は、肺がんの病態解明や、DNA複製ストレス耐性機構を治療標的とすることによる早期のがん予防や、新たな治療法の開発に期待が寄せられています。
● クロマチン構造の動的解析
名古屋大学の研究チームは、ヒトゲノムのダイナミックな立体構造の計算に成功しました[12]。この計算モデルは、大規模生化学データや顕微鏡データを統一的に説明すると同時に、ゲノム立体構造のダイナミックな揺らぎの予測を可能にします。これにより、クロマチン構造の動的な変化とその機能的意義についての理解が深まることが期待されます。
● まとめ
クロマチン研究は、遺伝子発現制御や細胞運命の予測、細胞機能の制御・設計において重要な役割を果たしています。最新の研究成果は、クロマチンの構造と機能の理解を一層深め、関連疾患の治療法確立にもつながる大きな期待が寄せられています[1][2][3][9][12]。これらの進展は、生命科学のみならず医学や薬学など幅広い分野においても、新たな展望を開くことになるでしょう。
- 参照・引用
-
[1] www.mext.go.jp/content/20210120-mxt_gakjokik-000010525_12.pdf
[2] www.jst.go.jp/pr/jst-news/backnumber/2023/202304/pdf/2023_4.pdf
[3] www.ncc.go.jp/jp/information/pr_release/2023/0907/index.html
[9] www.riken.jp/press/2020/20201126_1/
[12] www.nagoya-u.ac.jp/researchinfo/result/2022/05/post-265.html
未来の医学とバイオテクノロジーへの応用
クロマチンは、DNAとヒストンタンパク質が複合体を形成した構造であり、遺伝子の発現調節に重要な役割を果たしています。近年の研究により、クロマチンの構造や機能に関する理解が深まり、これが未来の医学とバイオテクノロジーにおける新たな応用へとつながっています。
● クロマチンの基本概念とその重要性
クロマチンは、遺伝情報のコンパクト化、DNAの保護、遺伝子の発現調節など、細胞の生命活動において中心的な役割を担っています。クロマチンの構造は、ヌクレオソームと呼ばれる単位から成り立っており、このヌクレオソームがさらに高次の構造を形成することで、DNAは細胞核内に効率的に収納されます[4]。
● クロマチンの医学・バイオテクノロジーへの応用
# ゲノム編集技術とクロマチン
クロマチンの構造や機能の理解は、ゲノム編集技術の発展にも寄与しています。特に、ヘテロクロマチンによる染色体異常の抑制機構の発見は、ゲノム編集を伴わない遺伝子治療への応用が期待されています[2][12]。このようなクロマチン制御によるアプローチは、従来のゲノム編集技術に比べて、より安全で効果的な治療法の開発につながる可能性があります。
# エピゲノム研究とクロマチン
クロマチンのアクセシビリティや構造の変化は、エピジェネティックな遺伝子発現制御に深く関わっています。ATAC-seq解析などの技術を用いたエピゲノム研究は、病気の原因解明や治療法の開発に貢献しています[13]。クロマチンのダイナミクスを理解することで、特定の遺伝子の発現を制御し、疾患の治療や予防に応用することが可能になります。
# クロマチン相互作用解析
クロマチン相互作用解析は、DNAの核内配置とその機能的な意味を解明するための重要な手法です。この技術を用いることで、転写制御やDNA修復など、細胞種特異的な制御メカニズムの理解が進みます[14]。これらの知見は、遺伝子発現の精密な制御を可能にし、未来の医療やバイオテクノロジーにおける新たな治療法や診断法の開発に寄与するでしょう。
● 結論
クロマチンの研究は、未来の医学とバイオテクノロジーにおいて重要な役割を果たします。クロマチンの構造や機能の理解を深めることで、ゲノム編集技術の進化、エピジェネティックな疾患治療法の開発、遺伝子発現の精密な制御など、多岐にわたる応用が期待されます。これらの進展は、疾患の治療や予防、さらには人類の健康と福祉の向上に大きく貢献するでしょう。
- 参照・引用
-
[2] resou.osaka-u.ac.jp/ja/research/2019/20190111_2
[4] www.yodosha.co.jp/jikkenigaku/keyword/3109.html
[12] www.kyushu-u.ac.jp/ja/researches/view/309/
[13] jp.illumina.com/content/dam/illumina-marketing/apac/japan/documents/pdf/webinar/200623-professional-webinar-atacseq.pdf
[14] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2018.900839/data/index.html