目次
CENP-A、セントロメアの構造と機能に不可欠なタンパク質についての解説。その結晶構造からユビキチン依存的な機能、ヌクレオソーム形成への関与まで、ライフサイエンスの最前線からの新着情報をお届けします。
第1章 CENP-Aの基礎知識
CENP-Aの定義と重要性
CENP-AヌクレオソームとCENP-Cによる特異的認識。(A)H3とCENP-Aの一次、二次、三次、四次構造の比較。配列と構造の変化はN末端領域、CATDのL1セグメント、C末端領域に集中している;(B)CENP-Aの疎水性C末端ペプチドをグラフトしたキメラヒストンH3を含むヌクレオソームに結合したCENP-Cモチーフの複合体の構造;(C)外側から内側へのキネトコア軸に沿ったキネトコアアセンブリの「青写真」としてのCENP-Cの組織を示すスキーム。H3ヌクレオソーム構造はX.laevis由来、CENP-Aヌクレオソーム構造はヒト由来、CENP-Cモチーフ結合構造はショウジョウバエのヌクレオソームコア粒子(ヒトCENP-AテールがH3にグラフトされている)とラットCENP-Cモチーフが結合したもの。
CENP-A(Centromere Protein A)は、ヒストンH3のバリアントであり、セントロメア領域に特異的に局在するタンパク質です。セントロメアは、染色体の中央部に位置し、細胞分裂時に姉妹染色体を分離する際の重要な役割を担っています。CENP-Aは、このセントロメア領域に特異的なヌクレオソームを形成し、セントロメアの構造と機能の維持に不可欠です[7][9]。
CENP-Aの存在は、セントロメアの形成と維持に必須であり、細胞分裂の正確性を保証する上で重要な役割を果たします。CENP-Aを含むヌクレオソームは、セントロメア領域特異的に集積するタンパク質群の目印となり、セントロメア領域のエピジェネティックな形成および維持が行われています[3]。また、CENP-Aは、セントロメアに特異的なヒストンであり、染色体上の位置に作られるネオセントロメアにも取り込まれることが示されています[6]。
CENP-Aの機能不全は、染色体の不正確な分配を引き起こし、ゲノム不安定性や多くの疾患、特にがんの発生に関連しています。そのため、CENP-Aの正確な局在と機能は、細胞の健康と生物の生存にとって極めて重要です[1][2][4][5]。
このように、CENP-Aはセントロメアの形成と機能維持において中心的な役割を果たし、細胞分裂の正確性を保つために不可欠なタンパク質であることが理解されています。
- 参照・引用
-
[1] www.nig.ac.jp/nig/images/research_highlights/PR20140624.pdf
[2] resou.osaka-u.ac.jp/ja/research/2020/20201118_1
[3] www.jstage.jst.go.jp/article/biophys/52/5/52_220/_pdf
[4] user.spring8.or.jp/sp8info/?p=23551
[5] www.waseda.jp/top/news/82707
[6] www.nig.ac.jp/nig/images/research_highlights/PR20130326.pdf
[7] sdgs.osaka-u.ac.jp/research/2384.html
[8] www.astellas-foundation.or.jp/pdf/research/24/h24_52_takayama.pdf
[9] www.weblio.jp/content/CENP-A
CENP-Aの局在とタンパク質構造
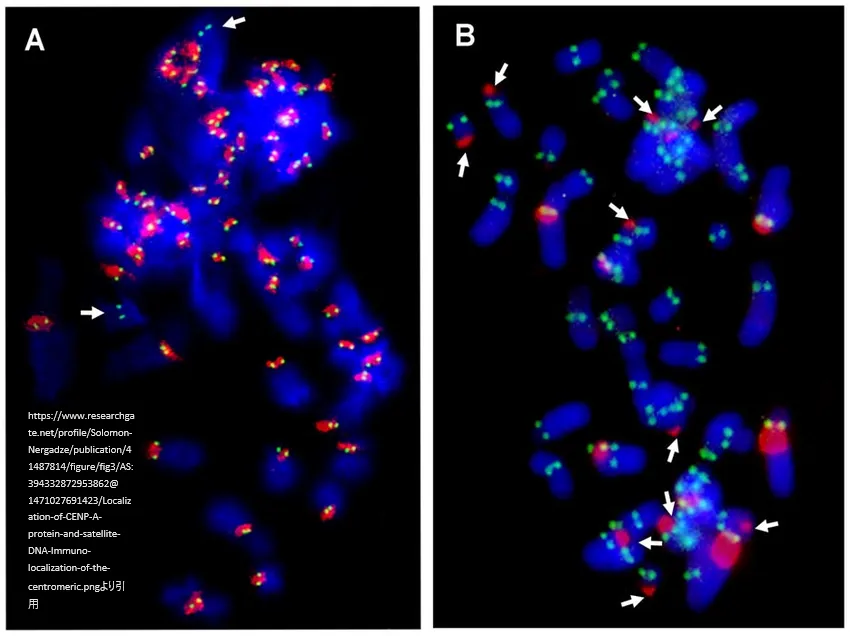
上図はウマ(A)およびロバ(B)のメタフェース上のセントロメリックタンパク質CENP-Aの免疫局在を、FITC標識二次抗体(緑)を用いた間接免疫蛍光法で実施。種特異的ゲノムDNAをFISHプローブとして用い、セントロメリックサテライトDNA(赤)を検出。
CENP-A(Centromere Protein A)は、ヒストンH3のバリアントであり、ほとんどの真核生物のセントロメア(染色体の中央部分に位置する特定の領域)の位置を決定する重要な役割を果たしています。CENP-Aは、セントロメアの位置をエピジェネティックに定義し、キネトコアの組み立てと姉妹染色分体の結合の最終的なサイトを決定します。このタンパク質は、セントロメア内の一部のヌクレオソーム内の標準的なH3ヒストンの一方または両方を置き換えるヒストンH3のバリアントです。CENP-Aは、ヒストンH3バリアントの中で最も配列の相違が大きく、標準的なヒストンH3とは48%の類似性しかありません。また、多くのよく知られたヒストン修飾サイト(H3K4、H3K9、H3K27など)が欠如している非常に異なるN末端テールを持っています[3]。
CENP-Aのヌクレオソームは、DNA複製と一緒にロードされることはなく、異なる生物で異なる細胞周期段階でロードされます。例えば、ヒトではG1期、ショウジョウバエではM期、S. pombeではG2期にロードされます。この特殊なロードを調整するために、CENP-A特有のヒストンシャペロンが存在します。ヒトではHJURP、ショウジョウバエではCAL1、S. pombeではScm3です[3]。
ヒストンシャペロンは、ヒストンタンパク質の適切な折りたたみやクロマチンへの組み込みを支援するタンパク質で、ヌクレオソームの組み立てと再構成過程で重要な役割を果たします。これらはヒストンの安定化や運搬を助け、DNAとの相互作用を調節することで遺伝子の発現をコントロールするのに寄与しています。
CENP-Aは、大部分の真核生物で大量の反復性サテライトDNAの大きなドメインにロードされます。CENP-Aの位置は、純粋にエピジェネティックなメカニズムによってタンパク質レベルで遺伝的に継承されます。これは、CENP-Aタンパク質がゲノムに結合する位置が、細胞分裂に伴って2つの娘細胞にコピーされることを意味します。CENP-Aが染色体から失われた場合、ヒト細胞では失敗セーフメカニズムが記述されており、CENP-BがサテライトDNA結合ドメインを介してCENP-Aをリクルートし、CENP-Aヌクレオソームでセントロメアを再構築します[3]。
CENP-Aは、CENP-CやCENP-Nを含む内部キネトコアタンパク質と直接相互作用します。この相互作用を通じて、細胞分裂中に微小管が染色体を正確に分離することができます[3]。
CENP-Aの過剰発現は、セントロメア以外の領域への誤った局在を引き起こし、染色体の誤分配と成長欠陥を引き起こすことが示されています。CENP-Aの過剰な部分は、プロテアソーム媒介性分解によって除去され、そのセントロメアでの排他的な存在を保証します[1][2]。
以上の情報から、CENP-Aはセントロメアの構造と機能において中心的な役割を果たし、その正確な局在と量の調節が染色体の正確な分離に不可欠であることがわかります。
第2章 CENP-Aの生化学的基盤
CENP-Aヌクレオソームの結晶構造
CENP-Aは、セントロメアの形成と維持に不可欠なヒストンH3のバリアントであり、特有のヌクレオソーム構造を形成します。CENP-Aヌクレオソームは、セントロメア領域特異的に集積するタンパク質群の目印となり、セントロメア領域のエピジェネティックな形成および維持が行われています[1]。CENP-Aを含むヌクレオソームのX線結晶構造解析により、CENP-Aヌクレオソームは、ヒストン複合体と安定的に結合しているDNAが短く、両端のDNAの配向が通常のヌクレオソームとは異なり決まっていないことがわかりました[15]。
CENP-Aヌクレオソームの結晶構造解析は、CENP-Aが含まれるヌクレオソームの特異性を明らかにする上で重要です。CENP-Aヌクレオソームは、通常のヌクレオソームと比較して、DNAとの結合様式が異なり、CENP-A特有のループ構造を持つことが示されています[1]。これらの構造的特徴は、セントロメア領域におけるCENP-Aヌクレオソームの機能的な役割を果たすために重要であると考えられます。
また、CENP-Aヌクレオソームは、セントロメア領域におけるキネトコア複合体の形成にも関与しています。CENP-Aヌクレオソームが形成する特徴的なクロマチン構造が、セントロメア領域特異的に集積するタンパク質群の目印となり、セントロメア領域のエピジェネティックな形成および維持が行われていることが示されています[1]。
さらに、CENP-Aヌクレオソームの結晶構造解析により、CENP-Aとその結合タンパク質との相互作用の鍵となるアミノ酸配列が、細胞や生物種ごとに異なることが示されています[3]。これは、CENP-Aの機能発現において重要なアミノ酸が、多くの研究者でデータが異なり、議論がある中で、CENP-Aの機能の核心を明らかにすることに貢献しています。
以上の研究成果から、CENP-Aヌクレオソームの結晶構造解析は、セントロメアの形成と維持におけるCENP-Aの生化学的基盤を理解する上で不可欠であることがわかります。これらの知見は、セントロメアの機能的な理解を深めるだけでなく、将来的には染色体分配の異常に関連する疾患の治療薬開発にも応用される可能性があります。
ユビキチン化とCENP-Aの機能調節
CENP-Aは、ヒストンH3のバリアントであり、染色体の遺伝的な継承を正確に導くために不可欠なセントロメアの特定と機能を担っています。CENP-Aのユビキチン化は、その機能の調節において重要な役割を果たしています。ユビキチン化は、タンパク質の運命を決定するポストトランスレーショナル修飾の一つであり、タンパク質の分解、局在、活性の調節に関与しています。
CENP-Aのユビキチン化は、セントロメアにおけるその位置のエピジェネティックなマーカーとして機能する可能性があります。CENP-AのK124残基のユビキチン化は、セントロメアへのCENP-Aの堆積に不可欠であるとされています。このユビキチン化は、CUL4A-RBX1-COPS8複合体によって媒介され、CENP-Aのセントロメアへの堆積に必要不可欠です[8]。また、ユビキチン化はCENP-Aの安定性にも寄与しており、セントロメアのアイデンティティの維持に重要な役割を果たしています[15]。
CENP-Aのユビキチン化は、そのクロマチンアセンブリファクターであるHJURPとの相互作用にも必要です。HJURPはCENP-Aのシャペロンであり、CENP-Aのセントロメアへのローディングと維持に関与しています。CENP-Aのユビキチン化は、HJURPとの結合を促進し、CENP-Aの安定化に寄与することが示唆されています[17]。
さらに、CENP-Aのユビキチン化は細胞分裂を通じて継承される可能性があります。CENP-Aのユビキチン化は、細胞周期の間に維持され、次の細胞分裂に向けてセントロメアの位置を決定するために重要な役割を果たすと考えられています[19]。
これらの知見は、CENP-Aのユビキチン化がセントロメアの機能と維持において中心的な役割を果たしていることを示しており、セントロメアのエピジェネティックなマーキングとキネトコアの組み立てにおけるその重要性を強調しています。
第3章 CENP-Aの細胞生物学的役割
セントロメアにおけるCENP-Aの組み込み
CENP-Aは、セントロメアの特定の位置にキネトコアを決定する重要な因子であり、ほとんどの真核生物、人間を含む、においてこの役割を果たしています[6]。セントロメアは染色体分離に不可欠な役割を果たし、CENP-Aはそのエピジェネティックなマークとして機能します。CENP-Aは、通常のヒストンH3とは異なる特殊なヒストンH3バリアントであり、セントロメア特異的なヌクレオソームの形成に関与しています[1][2][3]。
セントロメアにおけるCENP-Aの組み込みは、細胞周期に依存して行われます。人間では、CENP-AはG1期に、ショウジョウバエではM期に、S. pombeではG2期にロードされます[6]。この特殊なローディングは、CENP-A特異的なヒストンシャペロンによって調整されます。人間ではHJURP、ショウジョウバエではCAL1、S. pombeではScm3がそれにあたります[6]。
CENP-Aの組み込みは、セントロメアのエピジェネティックな継承に不可欠です。CENP-AはDNA複製中に希釈され、その結果生じた空白はヒストンH3で埋められますが、新しいCENP-Aは細胞周期の非常に早いG1期に再びデポジットされます[3]。一度デポジットされると、CENP-Aは非常に長い期間にわたって安定に継承されます[3]。
● セントロメアの機能とCENP-A
CENP-Aはセントロメアの機能にとって不可欠です。セントロメアはキネトコアタンパク質複合体の形成を指示し、正確な染色体分離を促進します[7]。CENP-Aは、セントロメア特異的なヌクレオソームの形成に関与し、キネトコアの組み立てとセントロメアの維持に重要な役割を果たします[16][18]。
CENP-Aの過剰発現は、細胞の運命に影響を与え、がん細胞においては、その減少は細胞成長の抑制、細胞周期の停止、アポトーシスの促進につながります[1]。さらに、CENP-Aのレベルの上昇はがんの進行と関連しており、患者の予後が悪いことと相関しています[1]。
● 結論
CENP-Aはセントロメアの機能と維持に不可欠なタンパク質であり、その正確な組み込みと継承は染色体の安定性と細胞分裂の正確性を保証します。CENP-Aの研究は、がん治療における新たな標的の発見につながる可能性があります。
- 参照・引用
-
[1] www.frontiersin.org/articles/10.3389/fcell.2022.907120/full
[2] www.ncbi.nlm.nih.gov/pmc/articles/PMC6404251/
[3] www.nature.com/articles/s41467-019-12019-6
[4] www.nature.com/articles/s41467-018-08073-1
[5] www.nature.com/articles/s42003-021-01941-5
[6] en.wikipedia.org/wiki/CENPA
[7] link.springer.com/article/10.1007/s10577-012-9301-4
[8] www.ncbi.nlm.nih.gov/pmc/articles/PMC2729997/
[9] www.ncbi.nlm.nih.gov/pmc/articles/PMC3501172/
[10] pubmed.ncbi.nlm.nih.gov/35015118/
[11] www.mdpi.com/2073-4425/13/10/1697
[12] www.pnas.org/doi/full/10.1073/pnas.130189697
[13] pubmed.ncbi.nlm.nih.gov/36292582/
[14] www.pnas.org/doi/full/10.1073/pnas.0700390104
[15] www.sciencedirect.com/science/article/pii/S1084952122001288
[16] www.sciencedirect.com/topics/neuroscience/centromere-protein-a
[17] www.cell.com/fulltext/S0092-8674%2811%2900116-4
[18] www.sciencedirect.com/topics/medicine-and-dentistry/centromere-protein-a
[19] rupress.org/jcb/article/217/6/1957/39300/Centromere-transcription-allows-CENP-A-to-transit
CENP-Aの染色体分配への関与
CENP-Aは、染色体の正確な分配に不可欠な役割を果たしています。CENP-AはヒストンH3のバリアントであり、特にセントロメアの特殊なヌクレオソームを形成することで知られています。これらのヌクレオソームは、セントロメアの維持とキネトコアの組み立てに中心的な役割を果たします[19]。CENP-Aは、セントロメア特異的なヒストンであり、キネトコアの組み立てを指示する中心的な役割を果たすと考えられています[14]。
CENP-Aの染色体への分配は、細胞周期にわたって調節されています。例えば、ヒトではCENP-Aの転写がG2/M期に起こり[17]、分裂酵母ではG1期に起こります[17]。これは、CENP-Aがセントロメアの機能と維持において、細胞周期特異的な役割を果たしていることを示唆しています。CENP-Aの分配は、新たに複製された染色体へのCENP-Aヌクレオソームの確実な分配を通じて、セントロメアのアイデンティティの維持に重要です[2]。
CENP-Aの過剰発現は、染色体の誤分配を増加させ、腫瘍形成や進行に役立つ可能性があります[12]。一方で、CENP-Aの初期のセントロメア/キネトコア組み立て後、CENP-Aはミトーシス中のセントロメア機能には不可欠ではないことが示されています[16]。これは、CENP-Aがセントロメアの初期組み立てには必要だが、その後の機能維持にはそれほど重要ではない可能性を示唆しています。
CENP-Aはまた、Sgo1と相互作用し、ミトーシス中のセントロメアへのSgo1の局在を決定することで、正確な染色体分配を導く役割を果たします[15]。これは、Sgo1とCENP-Aの相互作用がセントロメアの可塑性制御と正確な細胞分裂を導く以前に認識されていなかった直接的なリンクを明らかにしています。
以上の情報から、CENP-Aはセントロメアの機能と維持において中心的な役割を果たし、染色体の正確な分配に不可欠であることがわかります。CENP-Aの正確な調節は、細胞分裂の正確性を保証し、ゲノムの安定性を維持するために重要です。
- 参照・引用
-
[2] www.frontiersin.org/articles/10.3389/fcell.2022.914249/full
[12] www.ncbi.nlm.nih.gov/pmc/articles/PMC7397030/
[14] www.ncbi.nlm.nih.gov/pmc/articles/PMC1087704/
[15] academic.oup.com/jmcb/advance-article/doi/10.1093/jmcb/mjad061/7287371
[16] www.sciencedirect.com/science/article/pii/S2211124716315194
[17] www.sciencedirect.com/science/article/pii/S1084952122001288
第4章 CENP-A研究の最新動向
最新の研究成果と進行中の論文
CENP-Aは、ヒストンH3のバリアントであり、真核生物のほとんどの染色体のキネトコア位置を決定する重要な因子です。CENP-Aは、染色体のセントロメアにおけるキネトコアの組み立てと姉妹染色分体の結合の最終的な位置を決定するエピジェネティックなマーカーとして機能します[5]。最近の研究では、CENP-Aの過剰発現がゲノムの整合性に影響を与え、細胞の運命を再プログラムし、がんの進行に関連していることが明らかにされています[1][16]。
CENP-Aの核内分布は、健康な細胞とがん細胞で異なり、特にがんでは染色体領域の構造的および機能的な組織が変化することが示されています[1]。CENP-Aの過剰発現は、細胞の増殖、成長、移動、侵入性を減少させることによって、がん細胞の成長を抑制する可能性があります[1]。
CENP-Aのセントロメアへのリクルートには、HJURPというシャペロンが関与しており、CENP-Aのレベルは世代を超えて一定であることが示唆されています[12]。また、CENP-Aはセントロメアのアイデンティティを維持するために、細胞分裂を通じて安定して継承されることが知られています[3]。
最近の研究では、CENP-Aのヌクレオソームがセントロメア周辺でロゼット状の構造を形成し、これがセントロメアの機能的な役割に関連していることが示されています[6]。CENP-Aのセリン7位のリン酸化は、セントロメア機能の制御には不可欠ではないことが示されていますが、CENP-Aのアミノ末端の機能にはS16とS18が重要であることが示唆されています[7]。
CENP-Aのヌクレオソームは、ヒストンH3とは異なる構造的特性を持ち、特定の結合パートナーとの相互作用によってその長寿命が説明される可能性があります[3]。CENP-Aは、細胞周期を通じてセントロメアにリクルートされるCENP-CとCENP-Nと直接結合することが知られています[2][4]。
CENP-Aはがんの進行と関連しており、がん細胞におけるCENP-Aの過剰発現は染色体不安定性(CIN)と腫瘍進行に寄与することが示されています[13]。CENP-Aは、細胞が休止状態にある間もセントロメア機能を維持し、増殖能力を維持するために必要です[14]。
CENP-Aは、がんの進行に関連する遺伝子発現の変化に寄与する可能性があり、がん治療における潜在的な予後バイオマーカーとしての役割が示唆されています[19]。CENP-Aのヌクレオソームは、CENP-Cによってアンラップされることがあり、これがヒストンH2AのC末端を介して行われることが示されています[20]。
さらに、CENP-AとCENP-Bは協力して開放的なセントロメア構造を作り出し、CENP-Aの除去は細胞内でCENP-Bの動きを増加させることが示されています[11]。また、CENP-Aのヌクレオソームは、セントロメアの構造を原子レベルで明らかにするために、低温電子顕微鏡(cryo-EM)分析を用いて研究されています[17]。
これらの研究成果は、CENP-Aが細胞分裂とゲノムの整合性の維持において重要な役割を果たしていることを示しており、がん治療における新たな治療標的としての可能性を示唆しています。
- 参照・引用
-
[1] www.frontiersin.org/articles/10.3389/fcell.2022.907120/full
[2] portlandpress.com/essaysbiochem/article/64/2/205/225902/CENP-A-nucleosome-a-chromatin-embedded-pedestal
[3] www.ncbi.nlm.nih.gov/pmc/articles/PMC7659725/
[4] www.ncbi.nlm.nih.gov/pmc/articles/PMC6309197/
[5] en.wikipedia.org/wiki/CENPA
[6] www.nature.com/articles/s41467-019-12383-3
[7] www.nature.com/articles/s41467-018-08073-1
[8] www.ncbi.nlm.nih.gov/pmc/articles/PMC3501172/
[9] www.nature.com/articles/nature10258
[10] www.mdpi.com/2073-4425/11/7/810
[11] www.nature.com/articles/s41467-023-43739-5
[12] www.nature.com/articles/s41467-019-12019-6
[13] www.ncbi.nlm.nih.gov/pmc/articles/PMC7905998/
[14] www.ncbi.nlm.nih.gov/pmc/articles/PMC6783363/
[15] pubmed.ncbi.nlm.nih.gov/35422390/
[16] pubmed.ncbi.nlm.nih.gov/35721491/
[17] resou.osaka-u.ac.jp/en/research/2023/20230206_1
[18] www.uniprot.org/uniprotkb/P49450/entry
[19] www.frontiersin.org/journals/genetics/articles/10.3389/fgene.2022.931222/full
[20] www.embopress.org/doi/10.15252/embr.201948913
CENP-Aに関する今後の研究の方向性
CENP-Aは、セントロメアの特定の領域に存在するヒストンH3のバリアントであり、染色体の正確な分配に不可欠な役割を果たしています。近年の研究では、CENP-Aの構造、機能、およびセントロメアにおけるその役割に関する多くの新しい知見が明らかにされています。これらの研究成果を踏まえ、CENP-Aに関する今後の研究の方向性は以下のように展開されると考えられます。
1. CENP-Aの構造と機能のさらなる解明
– CENP-Aの詳細な構造解析を進め、その機能的なドメインや修飾部位の特定を行います。特に、CENP-Aのセントロメアへの取り込みや維持に関わる分子機構の解明が重要です。
2. CENP-Aのセントロメアへの取り込み機構の研究
– CENP-Aがセントロメアに取り込まれる過程には、HJURPなどのヒストンシャペロンが関与しています。これらのシャペロンとCENP-Aとの相互作用や、セントロメアへの取り込みに関わるシグナル伝達経路の詳細な解析が求められます。
3. CENP-Aの異常な機能と疾患との関連性の研究
– CENP-Aの過剰発現や異所性発現は、がんなどの疾患の発生に関連しています。CENP-Aの異常な機能がどのように疾患の発生や進行に寄与するのか、その分子機構の解明が重要です。
4. CENP-Aを標的とした新規治療戦略の開発
– CENP-Aの機能を特異的に調節することにより、がん細胞の増殖を抑制する新規治療法の開発が期待されます。CENP-Aを標的とした小分子化合物やペプチド、抗体などの開発が進められるでしょう。
5. CENP-Aの進化的な役割の研究
– CENP-Aは進化的に保存されたタンパク質であり、その進化的な起源や多様性に関する研究が進められます。異なる生物種におけるCENP-Aの機能的な違いや、セントロメアの進化におけるCENP-Aの役割の解明が期待されます。
これらの研究方向性は、CENP-Aの基礎的な理解を深めるとともに、セントロメアの機能維持に関わる新たな分子機構の発見や、がんなどの疾患治療への応用につながる可能性を秘めています。
CENP-Aヌクレオソームの構造
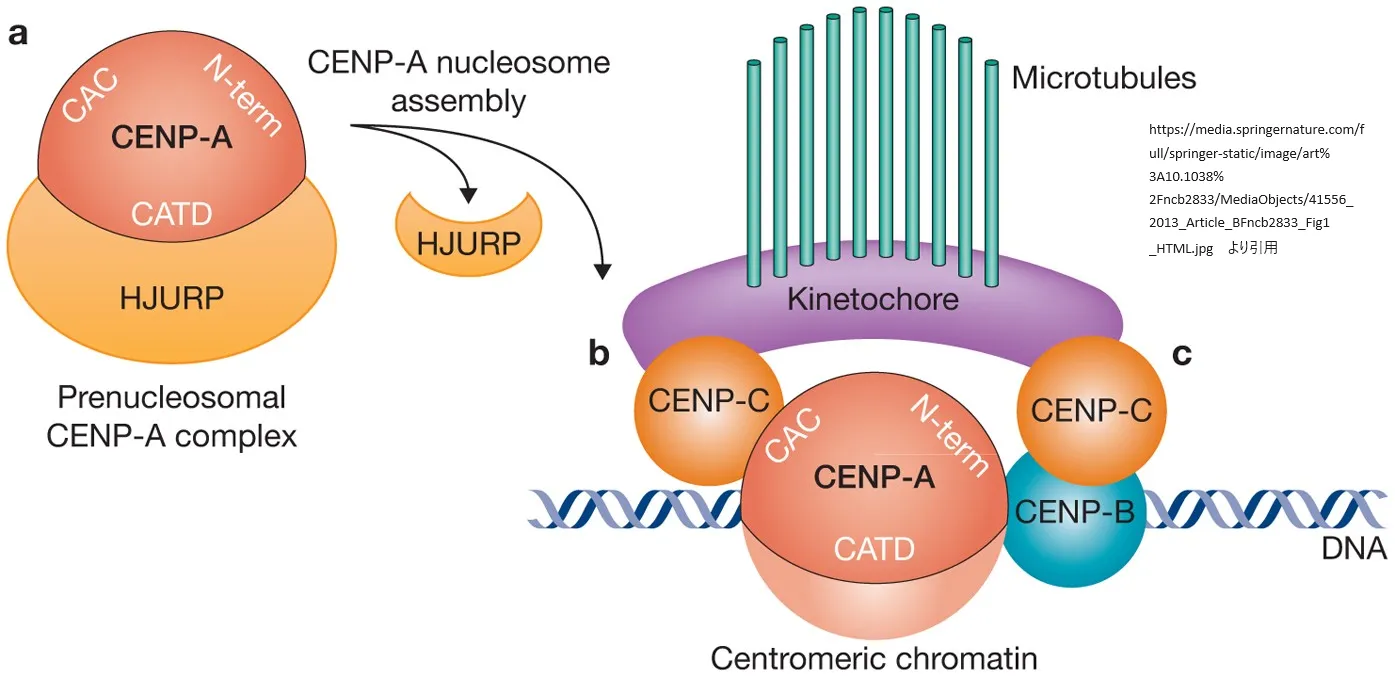
CENP-AはヒストンH3の特徴をいくつか持っていますが、その構造と機能において独自の役割を果たします。CENP-AはヒストンH4と強く相互作用し、ヒストンH2AおよびH2Bと共に、実験条件下(in vitro)でも生体内(in vivo)でも、従来型の8量体ヌクレオソームに組み込まれます。CENP-Aを含むヌクレオソームは、標準的なH3ヌクレオソームと多くの構造的特徴を共有していますが、その端部の接触は緩く、より短いDNAコアを持っています。CENP-Cとの結合によってこれらのヌクレオソームはさらに強化されます。細胞分裂時にキネトコアが効果的に組織され、姉妹染色体が正確に分離されるためには、CENP-Aの正確な認識が極めて重要です。細胞周期に沿ったCENP-Aヌクレオソームのダイナミクスと構造的変化を理解することが必要です。
セントロメアのヌクレオソームに直接結合するCCANキネトコアネットワークは、微小管のダイナミクスを制御し、細胞分裂中に染色体の正確な移動を保証する上で重要です。15のサブユニットで構成されるCCANネットワークが、細胞分裂時に必要なタイミングや位置でどのように機能するか、さらにこのネットワークが異なる細胞分裂機構を持つ生物種でどのように進化してきたかについては、80年以上にわたって研究が進められています。これまでの研究で、CENP-CとCENP-Nの2つのCCANサブユニットがCENP-Aと直接的に相互作用し、CENP-Aに対してH3ヌクレオソームとは異なる特異性を示していることが明らかになっています。
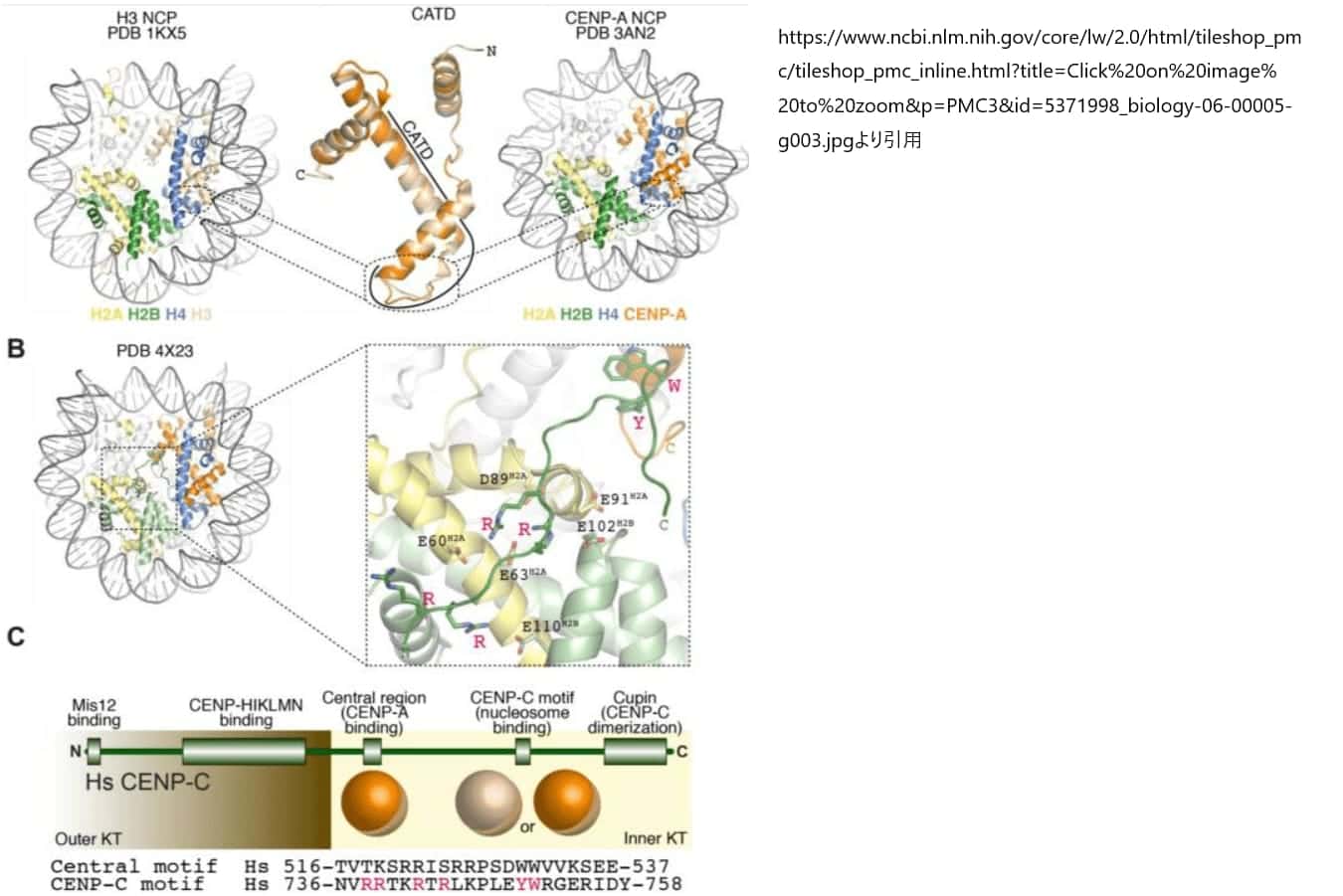
CENP-N
CENP-Nは、CENP-Aのセントロメア標的化ドメイン(CATD)に直接結合します。CATDは、CENP-Aのα1-α2ループ(L1ループ)とα2ヘリックスによって形成される領域であり、CENP-AとヒストンH3の配列の違いが顕著に表れる部分です。特に、L1ループでは塩基配列の差が集中しており、この部分はCATDの中で唯一の溶媒にさらされた領域でもあります。CATDは、セントロメア特有のクロマチンへCENP-Aを組み込むのに不可欠で、H3の対応する部位にこのドメインを移植すると、H3のキメラもセントロメアに組み込むことができるほどの機能を持っています。
CENP-C
CENP-Cは、ヌクレオソームの構成ヒストンであるH2AとH2B、およびCENP-AのC末端尾部と相互作用します。この相互作用には、CENP-Cの中央領域とCENP-Cモチーフという2つの特定の配列関連領域が関わっており、それぞれ独立してCENP-Aヌクレオソームに結合します。これらの領域は25残基からなり、N末端近くにはいくつかの正電荷を帯びた残基が、C末端近くには2つの芳香族残基が含まれています。N末端の正電荷領域はCENP-AヌクレオソームのH2AとH2Bに存在する酸性パッチと相互作用し、これによってカノニカルなH3ヌクレオソームとは異なるタンパク質との相互作用が促されると考えられています。
また、CENP-Cが結合するために必要なCENP-AのC末端尾部には、芳香族残基が存在して相互作用を行います。CENP-AのC末端尾部はH3のそれと比べて疎水性が高いという共通の特徴を持ち、進化的には緩やかな配列保存が見られます。ヒトのCENP-AとH3では、それぞれLeu-Glu-Gly-Leu-GlyおよびGlu-Arg-Alaの配列があり、このうちAVLIPFCは疎水性アミノ酸です。