脂質ラフトの一種であるカベオラは、多くの脊椎動物の細胞、特に内皮細胞・脂肪細胞・胚の脊柱細胞などに見られる細胞膜からの50~100ナノメートルという小さなフラスコ状陥入部である。cavolareは複数形、単数はcaveolarで、ラテン語の小洞窟という言葉に由来している。カベオラはフラスコ状の構造体で、タンパク質やコレステロール,スフィンゴ脂質などの脂質が豊富に含まれており、シグナル伝達に関わるいくつかの機能を有している。また、機械的保護、機械的センサー、エンドサイトーシス、癌化、病原性細菌や特定のウイルスの取り込みなどにも関与している。
カベオラの構造|カベオリン、カビン
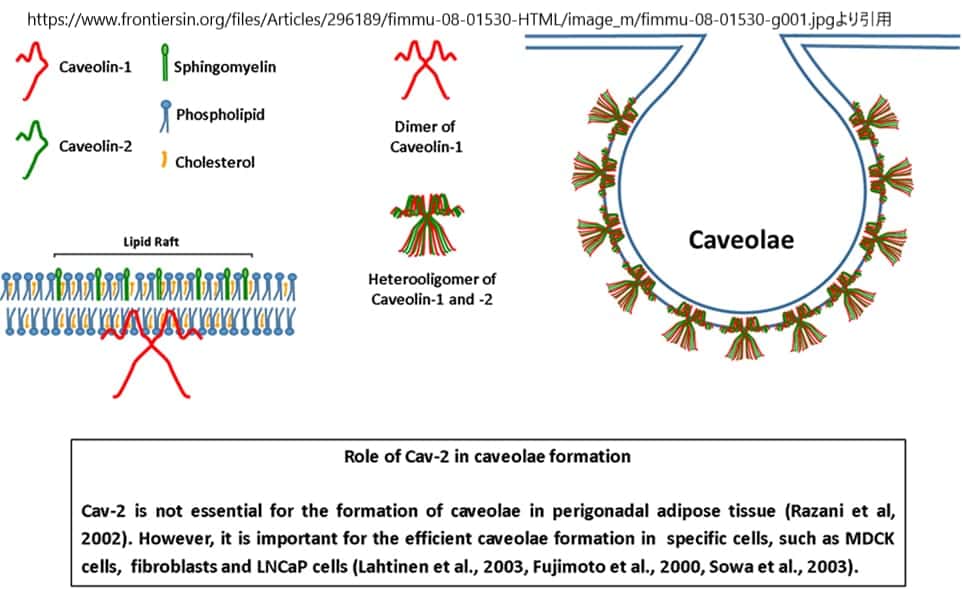
カベオリンとカビンはカベオラコート複合体を形成しており、電子顕微鏡ではカベオラの周囲にスパイク状のコートや条線が見られる。カベオリンには、非筋肉細胞に存在するカベオリン-1(CAV1)とカベオリン-2(CAV2)、そして筋肉に特異的なCAV3の3種類が知られている。各カベオラには約140〜150個のCAV1分子が存在する。
カベオラには,GTPaseであるdynamin(ダイナミン),dynamin-like ATPaseであるEHD2,BARドメイン含有タンパク質であるPACSIN2などの他のタンパク質やコレステロール、ホスホチジルセリン、PIP2などの脂質も結合している。
カベオリンCaveolin
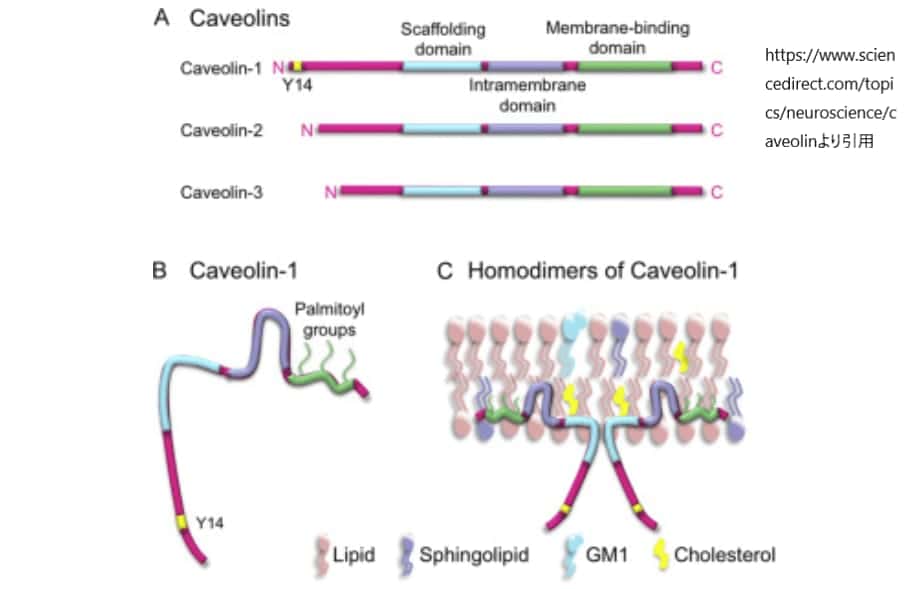
カベオリンは、膜内に埋め込まれたヘアピン型のドメインを持ち、アミノ末端とカルボキシ末端の両方が細胞質に面している。
カビンCavin
カベオリンの構造的・機能的に不可欠な構成要素としてカビンファミリーのタンパク質が同定されている。哺乳類のカビンタンパク質には、cavin1 (PTRF)、cavin2 (SDPR)、cavin3 (PRKCDBP)、そして筋肉特異的なcavin4 (MURC)の4種類がする。各カベオラには約50個のカビン分子が結合する。すべてのカビンは、配列の相同性があり、ヘリカル領域1 (HR1) およびHR2と呼ばれる保存されたα-ヘリカル二次構造を有している。カビンは互いにホモまたはヘテロのオリゴマーを形成しており、カビン1はオリゴマーの主要かつ必須の構成要素である。
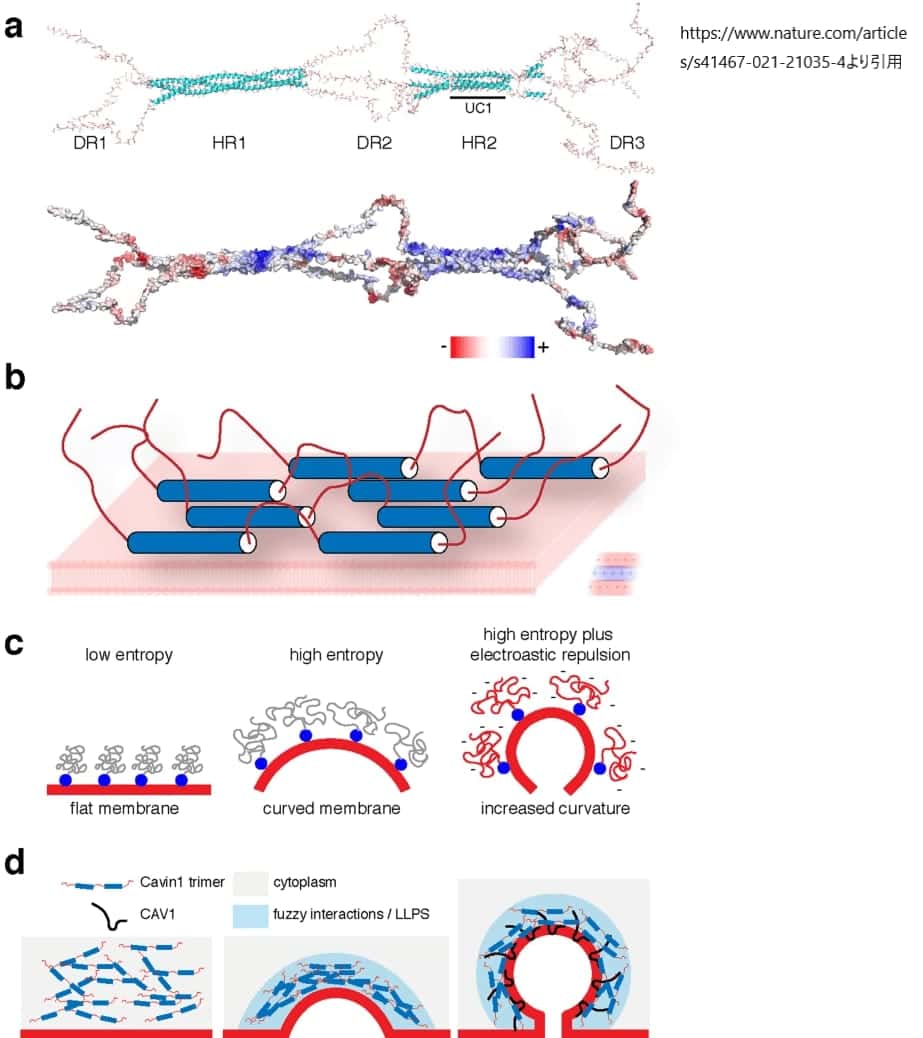
すべてのカビン蛋白質は、比較的高い配列保存性を有する2つのコアα-ヘリカル領域(HR1およびHR2)からなる非常に特徴的なドメイン構造を有している。これらの領域は、ほとんど配列の相同性はないが、負電荷を帯びた残基に富むという共通の性質をもつ3つの本質的に不規則な領域(DR1、DR2、DR3)によって連結されている。DRはdisordered regionsの略である。
カビンタンパク質は、カベオラの細胞質側にタンパク質コートを形成するホモオリゴマーおよびヘテロオリゴマーの複合体を形成することができ、必須アイソフォームであるカビン1は、他のファミリーメンバーが存在しない場合でも、カベオラ形成を促進するホモオリゴマーを形成することができる。Cavin1のN-末端のα-ヘリカルHR1ドメインは、三量体のコアとなるコイルドコイル構造を形成しており、Cavinファミリーの他のメンバー間のヘテロメリックな相互作用も促進する。HR1ドメインの表面に露出した塩基性アミノ酸残基は、ホスファチジルイノシトール-4,5-ビスリン酸(PI(4,5)P2)などのホスホイノシド脂質のヘッドグループに親和性を持つ。Cavin1のC末端のα-ヘリカルHR2領域は、UC1(Undecad of Cavin1)と呼ばれる第2のコイルドコイル構造を形成すると予測されるウンデカッド配列の繰り返し(11のモノマーが連結)を含んでいる。HR2ドメインとUC1ドメイン内の塩基性アミノ酸は、ホスファチジルセリン(PS)と結合し、カベオラの形成と安定性を制御する。これらの2つのα-ヘリカル脂質相互作用部位は、膜のリクルートやカベオラ膜の湾曲を生成するのに重要であると考えられている。
カベオラエンドサイトーシスとは?
カベオラエンドサイトーシスは、クラスリンに依存しないエンドサイトーシスプロセスであり、カベオラと呼ばれる50-60nmの球根状の細胞膜の陥入部を伴う。カベオラの形成は、カベオリンと呼ばれる内在性膜タンパク質と、カビンと呼ばれる膜周辺タンパク質によって推進される。
カベオラは動的なエンドサイト形成の担い手である。カベオラエンドサイトーシスでは、カベオラは細胞膜から芽生え、大部分は初期エンドソームに到達した後、細胞膜に戻される。カベオラエンドサイトーシスの経路には、カベオソームが関与していることが報告されているが、カベオソームは実際にはカベオリン1の過剰発現によって修飾された後期エンドソームである。
カベオラの出芽はダイナミンによって媒介され、EHD2はカベオラのエンドサイトーシスを負に制御する。アルブミン、葉酸、スフィンゴ糖脂質などはカベオラを介して内在化・エンドサイト化される物質である。
カベオラと細胞骨格
カベオラの組織化や輸送に細胞骨格が関与している。多くの細胞型では、アクチンストレスファイバーが細胞膜上のカベオラの直線的な分布に影響を与えている。チロシンキナーゼAblとホルミンmDIA1によって制御されているストレスファイバーは、カベオラの組織化と、基質からの細胞接着力の低下に応じて開始されるエンドサイトリートフィッキングに大きな役割を果たしている。アクチン結合タンパク質であるフィラミンAも、アクチンに結合したカベオラの移動に重要な役割を果たしている。微小管は、β1インテグリンとインテグリンリンクキナーゼ(ILK)のシグナルによって微小管を局所的に安定化させることで、カベオラのリサイクルを促進する。β1インテグリン-ILKは、アクチン結合タンパク質IQGAP1をリクルートし、mDIA1と一緒に微小管を安定化させる。アクチンと微小管の両方を制御するmDIA1は、カベオラの内在化とリサイクルの両方に不可欠である。
カベオラは、膜の伸張に反応して平らになる。カベオラのこの機械的感受性反応は、保護的な下流のシグナル伝達反応を活性化することに加えて、ストレス時の膜の破裂を防ぐ役割があると考えられている。CAV1は、インテグリンの活性化を含むいくつかの機械的刺激に反応してTyr14でリン酸化され、その結果、SRCキナーゼ阻害剤CSKがリクルートされてアクチンの再編成を媒介することになる。機械的ストレスに応答して、ホスホカベオリン1はカベオラの生合成を増加させ、それによって細胞が細胞表面のストレスに対処する能力を向上する。
カベオラと疾患
CAV1は、Rho依存性のアクトミオシン収縮を制御することが示されており、間質線維芽細胞では、これが局所的な腫瘍細胞の浸潤と転移を促進するが、癌におけるカベオリンの役割はまだ明らかになっていない。カベオリンは、腫瘍抑制機能を持っている可能性が高い。また、カベオラタンパク質の変異は、筋ジストロフィー、リポジストロフィー、心臓異常などの疾患にも関連している。






