目次
抗体依存性細胞傷害(ADCC)は、がん治療において重要な役割を果たす免疫メカニズムです。本記事では、ADCCの基本的なメカニズム、関連する臨床試験、新しい医薬品開発への応用について詳細に解説します。
第1章 ADCCの基本メカニズム
抗体と細胞の相互作用
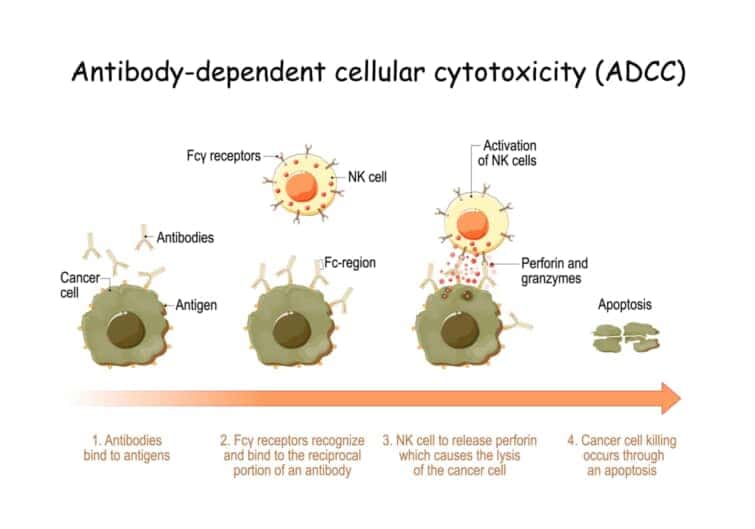
抗体依存性細胞傷害活性(ADCC)は、免疫系が標的細胞を認識し破壊するメカニズムの一つです。このプロセスでは、抗体が重要な役割を果たします。ADCCは、特定の抗体が標的細胞の表面に存在する抗原に結合した後に発生します。抗体の一部であるFc領域は、エフェクター細胞(主にナチュラルキラー細胞やマクロファージ)の表面にあるFc受容体と相互作用します[1][2][3][4]。
この相互作用により、エフェクター細胞は活性化され、標的細胞に対して様々な破壊メカニズムを発動します。エフェクター細胞は、標的細胞を直接攻撃するために、細胞毒性物質(例えば、グランザイムやパーフォリン)を放出します。これらの物質は標的細胞の細胞膜を破壊し、最終的に細胞死(アポトーシス)を引き起こします[4][8]。
ADCCの効果は、抗体のFc領域とエフェクター細胞のFc受容体との結合親和性に大きく依存します。この結合親和性を高めることで、ADCC活性を増強することが可能です。例えば、抗体のFc領域のアミノ酸配列を変更したり、アミノ酸に付加される糖鎖の構造を変更することで、Fc受容体との結合親和性を高め、ADCC活性を向上させることができます[8]。
ADCCは、がん治療や感染症治療における抗体医薬の作用機序として重要です。特に、がん細胞や感染症の病原体に特異的な抗原を標的とする抗体を用いることで、正常細胞への影響を最小限に抑えつつ、標的細胞のみを効果的に排除することが可能になります[1][2][4]。
このように、ADCCにおける抗体の役割は、標的細胞の特定とエフェクター細胞の活性化を通じて、標的細胞の破壊と排除を促進することにあります。このメカニズムは、免疫系が体内の異常細胞や病原体を認識し、排除するための重要な戦略の一つです。
- 参考文献・出典
-
[1] www.glycoforum.gr.jp/glycoword/immunity/IS-A06J.html
[2] www.ncc.go.jp/jp/information/pr_release/2016/0215/index.html
[3] www.yodosha.co.jp/jikkenigaku/keyword/2150.html
[4] oncolo.jp/dictionary/adcckassei
[5] www.jst.go.jp/crest/immunesystem/result/03.html
[6] www.jbpo.or.jp/med/jb_square/autoimmune/immunology/im06/01.php
[7] m-hub.jp/biology/1011/interaction-between-antigen-and-antibody
[8] bio.nikkeibp.co.jp/atcl/report/16/011900001/19/06/20/00258/
エフェクター細胞の活性化
エフェクター細胞、特にナチュラルキラー(NK)細胞の活性化プロセスとその制御について解説します。エフェクター細胞は、免疫系において重要な役割を果たす細胞で、異物や異常細胞を直接攻撃することで生体を守ります。NK細胞は、このエフェクター細胞の一種であり、特にウイルス感染細胞やがん細胞を認識し、排除する能力を持っています。
● NK細胞の活性化プロセス
NK細胞の活性化は、主に細胞表面の受容体によって制御されます。NK細胞には、活性化受容体と抑制受容体の二種類が存在し、これらの受容体の相互作用によってNK細胞の活性化が調節されます[13][18]。
– 活性化受容体は、ウイルス感染細胞やがん細胞に特有のリガンドを認識することで、NK細胞の攻撃機能を促進します。例えば、NKG2Dは活性化受容体の一つであり、ウイルス感染や細胞のがん化によって誘導される宿主クラスI様分子を認識します[20]。
– 抑制受容体は、正常細胞の表面に存在するMHCクラスI分子と結合することで、NK細胞の攻撃を抑制します。これにより、NK細胞は正常細胞を攻撃することなく、異常細胞のみを排除することができます[13][18]。
● NK細胞の制御
NK細胞の活性化は、細胞内シグナル伝達経路を介して行われます。活性化受容体がリガンドと結合すると、シグナル伝達経路が活性化され、細胞傷害性分子の放出やサイトカインの産生が促進されます。これにより、NK細胞は標的細胞を攻撃し、排除することができます[18]。
NK細胞の活性化と機能は、免疫応答のバランスを保つために厳密に制御されています。例えば、NK細胞はIL-2やIL-15などのサイトカインによっても活性化されることが知られています。これらのサイトカインは、NK細胞の増殖や生存を促進し、免疫応答を強化します[18]。
また、NK細胞の活性化は、免疫系全体の調節によっても影響を受けます。T細胞やB細胞など他の免疫細胞との相互作用によって、NK細胞の活性化が調節されることがあります。これにより、免疫応答が適切に調整され、過剰な反応や自己免疫反応が抑制されます[18]。
NK細胞の活性化とその制御は、生体の防御機構において重要な役割を果たします。NK細胞の適切な活性化と制御により、ウイルス感染やがん細胞に対する効果的な免疫応答が可能となり、生体の健康が維持されます。
- 参考文献・出典
-
[13] files.jsi-men-eki.org/general/q_a/sorimachi.pdf
[14] blog.cellsignal.jp/faster-immuno-oncology-research-with-rapid-t-cell-activation-expansion
[15] www.nutri.co.jp/nutrition/keywords/ch4-1/keyword2/
[16] nkmax.com/jpn/bbs/content.php?co_id=nkcell
[17] jaci.jp/patient/immune-cell/immune-cell-11/
[18] www.thermofisher.com/jp/ja/home/life-science/cell-analysis/cell-analysis-learning-center/immunology-at-work/natural-killer-cell-overview.html
第2章 臨床でのADCCの利用
ADCCを活用した医薬品の例
タンパク質分析における分子量の計算は、生物学および生化学の研究において重要な役割を果たします。タンパク質の分子量は、その構造、機能、および細胞内での役割を理解する上で基本的な情報を提供します。以下に、タンパク質分析における分子量の役割について詳述します。
● タンパク質の同定と特性評価
タンパク質の分子量は、特定のタンパク質を同定し、その特性を評価するための基本的な指標となります。質量分析(MS)やSDS-PAGE(ポリアクリルアミドゲル電気泳動)などの技術を用いて測定された分子量は、既知のタンパク質データベースと照合することで、未知のタンパク質の同定に役立ちます[1][3][9]。
● タンパク質の構造解析
タンパク質の分子量は、その構造解析にも重要な情報を提供します。例えば、質量分析によって得られた分子量から、タンパク質が単量体であるか、または複数のサブユニットから構成される多量体であるかを推定することができます[1][12]。また、タンパク質の分子量の変化を追跡することで、ポストトランスレーショナル修飾(翻訳後修飾)の存在や、タンパク質間相互作用の有無を検出することも可能です。
● 生物学的機能の理解
タンパク質の分子量は、その生物学的機能を理解する上でも重要です。例えば、酵素の活性部位や受容体との結合部位など、特定の機能を持つドメインは、しばしば特定の分子量範囲に存在します。分子量の情報を用いて、これらの機能的ドメインの存在や配置を推定することができます[1][3]。
● 疾患診断と治療への応用
タンパク質の分子量は、疾患の診断や治療のターゲットとしても重要です。特定の疾患に関連するタンパク質や、疾患の進行に伴って変化するタンパク質の分子量を特定することで、新たなバイオマーカーや治療標的の同定につながります[1][12]。
● まとめ
タンパク質の分子量の計算と分析は、タンパク質の同定、構造解析、生物学的機能の理解、疾患診断と治療への応用など、生物学および生化学の多岐にわたる分野で重要な役割を果たします。分子量の正確な測定と解析により、タンパク質の詳細な特性を明らかにし、生命科学の進展に貢献しています。
進行中の臨床試験と期待される成果
抗体依存性細胞媒介性細胞障害(ADCC)は、抗体を使用してがん細胞を標的にし、破壊する免疫システムのメカニズムです。このメカニズムは、がん治療のための効果的な免疫療法を開発するために、さまざまな臨床試験で探求されています。ADCCベースの免疫療法の進行中の臨床試験と期待される成果は多岐にわたり、がん治療におけるこのアプローチの複雑さと可能性を反映しています。
いくつかの臨床試験では、ADCC活性を持つモノクローナル抗体(mAbs)とエンジニアリングされたナチュラルキラー(NK)細胞を組み合わせることで、優れた臨床反応が得られることが報告されています。これは、ADCCをエンジニアリングされたNK細胞を使用することで増強できることを示唆しており、NK細胞がADCCを媒介する上での重要な役割を果たしています。これらの試験は、NK細胞による破壊へのがんの抵抗を克服するための有望な方向性を示しており、さまざまな種類のがん患者にとって改善された結果につながる可能性があります。
NK細胞ベースの免疫療法に焦点を当てた初期の臨床試験、ADCCメカニズムを活用する試験を含む、は血液がんおよび固形がんの治療において励みになる結果を示しています。患者の25%未満で完全寛解が観察されたものの、これらの試験はNK細胞療法の優れた安全性プロファイルと、ADCCを強化するための他の治療剤との組み合わせの可能性を強調しています。試験間で観察されたNK細胞の持続性と拡大の変動性は、異なるがんの種類と病期にこれらの療法を最適化するためのさらなる研究の必要性を強調しています。
NK細胞ベースのがん免疫療法の開発は、活発な研究分野のもう一つです。これらの療法は、NK細胞のがん細胞への特異性と効果を高めることを目的としており、ADCCベースの治療の成果を改善する可能性があります。NK細胞移植とモノクローナル抗体の組み合わせは臨床試験で評価されており、このアプローチで治療された患者の一部で客観的な臨床反応が示されています。この戦略は、モノクローナル抗体によって標的とされたがん細胞とのNK細胞の相互作用を強化することにより、NK媒介のADCCを増強することを目指しています。
要約すると、ADCCベースの免疫療法は、さまざまな種類のがんを治療するための潜在能力を持つとして、臨床試験で積極的に評価されています。進行中の研究と開発努力は、現在の療法の限界、例えばNK細胞による破壊への抵抗や治療反応の変動性を克服することを目指しています。NK細胞をエンジニアリングし、それらをモノクローナル抗体と組み合わせることにより、研究者はADCCの効果を高め、患者にとってより良い臨床成果を達成することを期待しています。これらの試験の期待される成果には、改善された反応率、より長い寛解期間、およびがん患者の全体的な生存率の向上が含まれます。しかし、ADCCベースの免疫療法の潜在能力を完全に実現するためには、さらなる研究と臨床試験が必要です。
第3章 ADCCの予測と測定手法
ADCC活性の予測モデル
ADCC(Antibody-Dependent Cellular Cytotoxicity、抗体依存性細胞傷害)は、特定の抗体が標的細胞に結合し、その後、免疫細胞(主にナチュラルキラー細胞)が標的細胞を認識して破壊するプロセスです。ADCC反応の予測は、がん治療や感染症治療における抗体療法の開発において重要な役割を果たします。以下に、ADCC反応を予測するための現在のモデルとアプローチを概説します。
1. 生物学的特性に基づく予測
ADCC活性の予測には、抗体の生物学的特性を考慮するアプローチがあります。例えば、抗体の糖鎖構造はADCC活性に影響を与えることが知られており、特定の糖鎖修飾がADCC活性を増強することが報告されています[2]。また、抗体のFc領域とFcγ受容体との親和性もADCC活性に影響を及ぼし、この親和性を高めることでADCC活性を増強できることが示されています[5]。
2. 分子モデリングと構造予測
分子モデリングや構造予測を用いたアプローチもADCC活性の予測に利用されます。抗体と標的細胞表面の抗原、または抗体とFcγ受容体との結合部位の構造を解析し、ADCC活性に寄与する可能性のあるアミノ酸残基や構造的特徴を特定します[9]。この情報を基に、ADCC活性を高めるための抗体の改変や設計が行われます。
3. ハイスループットスクリーニング
ADCC活性を予測するためのハイスループットスクリーニング(HTS)技術も開発されています。画像ベースのADCCアッセイをハイコンテントスクリーニング(HCS)に適用し、大量の化合物や抗体候補からADCC活性を調節するものを迅速に同定する方法が紹介されています[7]。このアプローチにより、効果的なADCC誘導剤の発見が加速されます。
4. 免疫細胞モデルを用いた評価
ADCC活性の予測には、免疫細胞モデルを用いた評価も重要です。特に、ヒト化マウスモデルやPBMC(末梢血単核細胞)を用いたin vivoおよびin vitro試験が有効です[12]。これらのモデルを用いることで、実際の生物学的環境におけるADCC反応の予測が可能となります。
● 結論
ADCC活性の予測には、生物学的特性に基づくアプローチ、分子モデリングと構造予測、ハイスループットスクリーニング、免疫細胞モデルを用いた評価など、複数の方法が存在します。これらのアプローチを組み合わせることで、より正確なADCC活性の予測が可能となり、効果的な抗体療法の開発に貢献します。
- 参考文献・出典
-
[2] www.jstage.jst.go.jp/article/dds/36/5/36_342/_pdf
[3] eprints.lib.hokudai.ac.jp/dspace/bitstream/2115/70104/1/Masahiro_Ikeda.pdf
[4] www.jstage.jst.go.jp/article/dds/36/1/36_28/_pdf
[5] www.chugai-pharm.co.jp/cont_file_dl.php?f=FILE_1_37.pdf&rep=117%2C37&src=%5B%250%5D%2C%5B%251%5D
[6] www.hemapedia.jp/hemapedia/basic-immunity-course/season2-lesson02
[7] app.jove.com/t/64485?language=Japanese
[8] repo.lib.tokushima-u.ac.jp/files/public/10/105909/20170929150237918095/LID201310231003.pdf
[9] api.lib.kyushu-u.ac.jp/opac_download_md/1785379/phar0574_review.pdf
[10] med.mochida.co.jp/medicaldomain/gastroenterology/adalimumab/info/drugefficacy.html
[11] www.jstage.jst.go.jp/article/fpj/136/4/136_4_210/_pdf
[12] crownmbl.co.jp/model-systems/in-vivo/humanized-models
in vitroでのADCCアッセイ技術
ADCC(抗体依存性細胞媒介性細胞障害)は、ヒト免疫系において、特定の抗体が標的細胞に結合し、その後、効果細胞(主にナチュラルキラー細胞)が抗体のFc領域に結合して標的細胞を破壊するメカニズムです。このプロセスは、がん治療や感染症治療における抗体療法の重要な作用機序の一つとされています。研究室レベルでADCC活性を測定するためには、いくつかの標準的なアッセイ技術が存在し、それぞれに特徴と精度の違いがあります。
● 標準的なADCCアッセイ技術
1. クロミウム放出アッセイ(^51Cr放出アッセイ)
– 長年にわたりADCCアッセイのゴールドスタンダードとされてきました。この方法では、標的細胞に放射性同位体クロミウム^51Crを取り込ませ、その後、抗体と効果細胞を加えてインキュベートします。標的細胞が破壊されると^51Crが放出され、その量を測定することでADCC活性を評価します[16]。しかし、放射性物質を使用するため、取り扱いには注意が必要です。
2. 蛍光放出アッセイ
– 放射性物質を使用しない代替手法として、蛍光物質(例:カルセインAM)を標的細胞に取り込ませ、細胞破壊による蛍光物質の放出を測定する方法があります。この手法は、^51Cr放出アッセイに比べて安全性が高く、より簡単に実施できますが、感度や特異性においては^51Cr放出アッセイに劣る場合があります[8]。
3. ルシフェラーゼ報告アッセイ
– 効果細胞または標的細胞にルシフェラーゼ遺伝子を導入し、ADCC反応による細胞死または活性化をルシフェラーゼ活性の変化として測定する方法です。この手法は高い感度を持ち、定量的なデータが得られるため、近年注目されています[1][7]。
● 精度と検証
ADCCアッセイの精度は、特異性、再現性、および線形性によって評価されます。特異性は、アッセイが特定のADCC反応のみを測定していることを保証します。再現性は、同じ条件下でアッセイを複数回実施した際に、一貫した結果が得られることを意味します。線形性は、標的細胞の濃度や抗体の濃度が変化しても、測定結果が比例して変化することを指します[1][3]。
ADCCアッセイの精度を向上させるためには、標的細胞と効果細胞の選択、抗体の濃度、インキュベーション時間などの実験条件を最適化することが重要です。また、異なるドナーからの効果細胞を使用する場合は、ドナー間の変動を考慮に入れる必要があります[6][13]。
● 結論
ADCCアッセイは、抗体療法の効果を評価するための重要なツールです。^51Cr放出アッセイ、蛍光放出アッセイ、ルシフェラーゼ報告アッセイなど、複数のアッセイ技術が存在し、それぞれに利点と欠点があります。アッセイの精度を確保するためには、特異性、再現性、線形性を検証し、実験条件を最適化することが必要です。
- 参考文献・出典
-
[1] www.nature.com/articles/s41598-020-73960-x
[2] www.creative-biolabs.com/drug-discovery/therapeutics/adcc-assay.htm
[3] www.ncbi.nlm.nih.gov/pmc/articles/PMC3355484/
[4] www.nature.com/articles/srep19772
[5] www.bioagilytix.com/blog/adcc-and-cdc-assay-validation-and-optimization/
[6] www.agilent.com/cs/library/applications/cell-mediated-cytotoxicity-ADCC-assay-5994-2556EN-agilent.pdf
[7] www.ncbi.nlm.nih.gov/pmc/articles/PMC7975276/
[8] www.ncbi.nlm.nih.gov/pmc/articles/PMC4728441/
[9] www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2019.01025/full
[10] www.ncbi.nlm.nih.gov/pmc/articles/PMC3285017/
[11] www.viviabiotech.com/adcc-cdc-activity-ex-vivo-assays-at-physiological-levels/
[12] www.agilent.com/cs/library/applications/automated-DELFIA-ADCC-assay-5994-2478EN-agilent.pdf
[13] pubmed.ncbi.nlm.nih.gov/30395815/
[14] academic.oup.com/abt/article/1/1/7/5057809
[15] pubmed.ncbi.nlm.nih.gov/24704820/
[16] www.sciencedirect.com/science/article/abs/pii/S0731708523004247
第4章 抗体の設計とADCCの最適化
ADCC向けの抗体エンジニアリング
抗体依存性細胞傷害(Antibody-Dependent Cellular Cytotoxicity, ADCC)は、抗体が特定の抗原を持つ細胞に結合し、その結合を介して免疫細胞(主にナチュラルキラー細胞)が標的細胞を破壊するメカニズムです。このメカニズムは、がん治療や感染症治療における抗体医薬品の重要な作用機序の一つとされています。ADCCの効果を最大化するための抗体設計には、様々なエンジニアリング技術が用いられており、近年ではさらに進化した技術が開発されています。
● 抗体のFc領域の改変
ADCC活性は、抗体のFc領域が免疫細胞のFcγ受容体に結合することで発揮されます。この結合親和性を高めることでADCC活性を増強することが可能です。例えば、米Xencor社はFc領域のアミノ酸配列を変更してADCC活性を増強する「XmAb」という技術を開発しました[14]。また、協和発酵キリンは、Fc領域のフコース修飾を制御してADCC活性を高める「ポテリジェント技術」を保有しています[13]。
● 糖鎖エンジニアリング
抗体のFc領域に結合する糖鎖の構造もADCC活性に影響を与えます。特に、フコースの除去はADCC活性を顕著に増強します。協和発酵キリンのポテリジェント技術は、この原理を利用しており、フコース非修飾抗体が高いADCC活性を示すことが知られています[7]。また、細胞増殖促進因子ポリアミンが抗体の糖鎖修飾に関わることが示され、特に糖鎖のガラクトシル化がADCC活性に影響を及ぼすことが明らかにされています[16]。
● バイスペシフィック抗体
バイスペシフィック抗体は、2種類の異なる抗原を同時に認識する能力を持つ抗体で、ADCCを含む複数の免疫応答を同時に引き起こすことができます。この技術は、特定の細胞タイプをより効果的に標的とすることを可能にし、ADCCの効果を最大化します[10]。
● まとめ
ADCCの効果を最大化するための抗体エンジニアリング技術は、Fc領域の改変、糖鎖エンジニアリング、バイスペシフィック抗体の開発など、多岐にわたります。これらの技術は、抗体医薬品の効果を高め、がんや感染症などの治療においてより良い治療成績をもたらすことが期待されています。
- 参考文献・出典
-
[7] www.jstage.jst.go.jp/article/dds/26/6/26_6_611/_pdf
[8] www.chugai-pharm.co.jp/cont_file_dl.php?f=FILE_1_94.pdf&rep=117%2C94&src=%5B%250%5D%2C%5B%251%5D
[9] www.epsilon-mol.co.jp/tsuchiya-column/20201221/
[10] bio.nikkeibp.co.jp/atcl/column/16/052700070/122200022/
[11] www.chugai-pharm.co.jp/cont_file_dl.php?f=FILE_1_37.pdf&rep=117%2C37&src=%5B%250%5D%2C%5B%251%5D
[12] www.amed.go.jp/content/000115592.pdf
[13] www.nihs.go.jp/cbtp/home/Biologics-forum/BF10/2-DrKohata.pdf
[14] bio.nikkeibp.co.jp/atcl/report/16/011900001/19/06/20/00258/
[15] www.pmda.go.jp/files/000206143.pdf
[16] prtimes.jp/main/html/rd/p/000000046.000102047.html
糖鎖修飾によるADCC活性の向上
抗体依存性細胞傷害活性(ADCC)は、標的細胞に結合した抗体がナチュラルキラー細胞(NK細胞)やマクロファージなどのエフェクター細胞上のFc受容体と結合することで、抗体依存的に誘導される標的細胞傷害活性です。このADCC活性は、抗体医薬の薬効発現のメカニズムにおいて重要な役割を果たしています。抗体の糖鎖修飾は、このADCC活性に大きな影響を与えることが知られており、特にフコースの除去やガラクトースの追加などの糖鎖修飾がADCC活性を向上させることが報告されています。
● フコースの除去によるADCC活性の向上
フコース非修飾抗体は、通常の抗体に比べてADCC活性が飛躍的に強くなることが知られています。フコースを含まないN-結合型糖鎖を持つ抗体は、FcγRIIIa受容体との親和性が高まり、結果としてADCC活性が増強されます。このフコース非修飾抗体の開発には、POTELLIGENT®技術などが用いられています[6]。
● ガラクトースの追加によるADCC活性の向上
糖鎖を構成する糖の中で、ガラクトースの追加もADCC活性の増強に寄与します。ガラクトースを追加することで、抗体のFc部分の糖鎖構造が変化し、これがエフェクター細胞のFc受容体との相互作用を強化し、ADCC活性を向上させると考えられています[2]。
● 糖鎖修飾の調節方法
糖鎖修飾によるADCC活性の向上を実現するためには、遺伝子工学的手法や細胞培養技術の最適化が重要です。フコースの除去には、特定の酵素を用いてフコースを含む糖鎖を特異的に除去する方法や、フコースを付加する酵素の遺伝子をノックアウトした細胞株を使用する方法があります。ガラクトースの追加には、ガラクトシルトランスフェラーゼの活性を高めることで、抗体の糖鎖にガラクトースを効率的に追加する方法があります。また、細胞培養条件の最適化により、糖鎖修飾パターンを調節することも可能です[13]。
● 結論
抗体の糖鎖修飾はADCC活性に大きな影響を与え、特にフコースの除去やガラクトースの追加によってADCC活性が向上します。これらの糖鎖修飾を効果的に行うためには、遺伝子工学的手法や細胞培養技術の最適化が必要です。糖鎖修飾によるADCC活性の向上は、抗体医薬の有効性を高めるための重要な戦略の一つとなっています。






