目次
この記事では、GCリッチ領域を含むDNA断片のPCR増幅に関する課題と解決策を紹介します。高GC含有率のDNA領域を効率的に増幅するための条件、適用可能なポリメラーゼ、および増幅効率を最大化するための実験的アプローチに焦点を当てています。PCRプロセスの最適化からトラブルシューティングまで、実験室での作業を支援するための実践的な情報を提供します。
第1章: GCリッチ領域とは
GCリッチ領域の特徴
● GC含有率が60%以上のDNA領域の定義と重要性
GCリッチ領域とは、DNA配列中のグアニン(G)とシトシン(C)の含有率が60%以上の領域を指します。これらの領域は、G塩基とC塩基との間の水素結合が強固であるため、DNAの二重らせん構造が特に安定しています[13]。
G塩基(グアニン)とC塩基(シトシン)との間の水素結合が強固な理由は、GとCが3箇所で水素結合を形成するためです。具体的には、GとCの分子構造が互いに凸凹が噛み合うようになっており、この時、非共有電子対を持つ酸素(O)や窒素(N)と、水素(H)が向かい合って水素結合ができるわけですが、それがGとCのペアでは3箇所あるため、水素結合がより多く、結果として結合が強固になります。この強固な水素結合により、GとCが多いDNA領域は熱によって二重らせんが解けにくくなる特性を持ちます。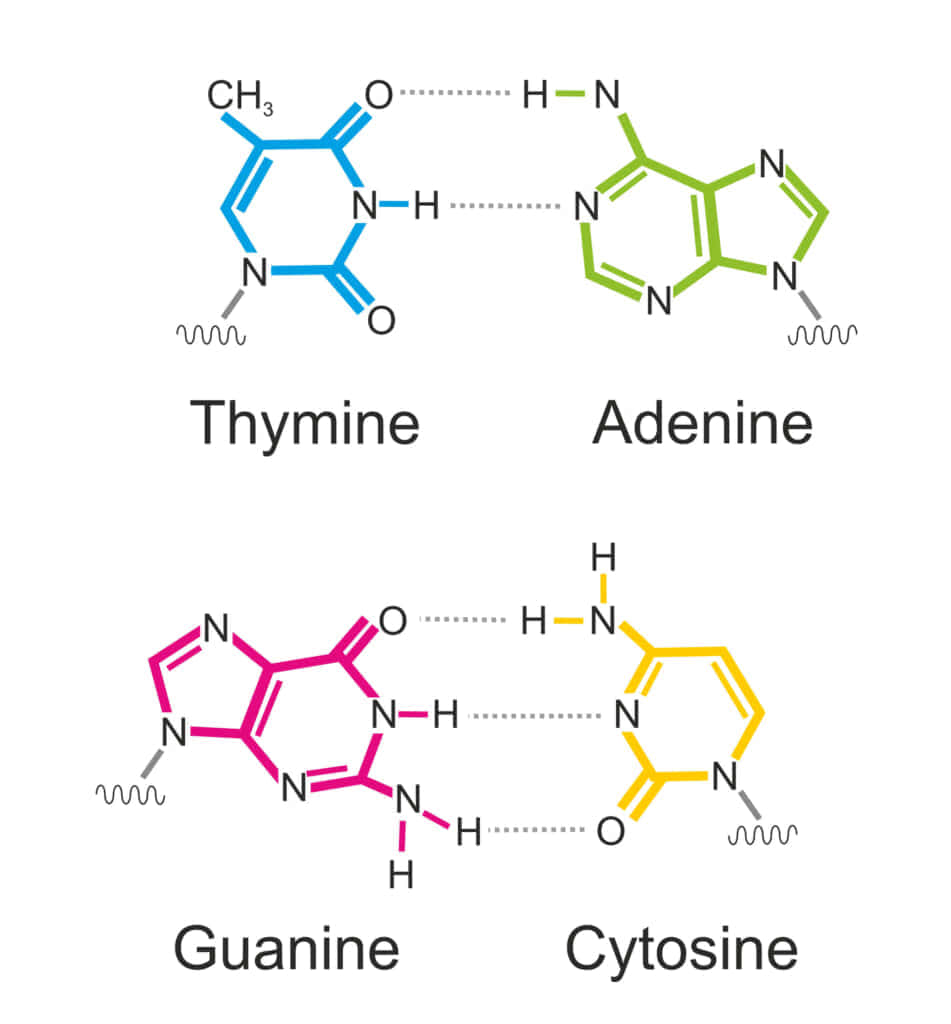
GC含有率が高いDNAテンプレートは、G塩基とC塩基との間のより強い水素結合のため、増幅するのが困難になることがあります[11]。また、GCリッチ領域は、二次構造にも関係し、DNAポリメラーゼがテンプレートにアクセスするのを妨げることがあります[13]。
● GCリッチ領域が遺伝子発現と機能に与える影響
GCリッチ領域は、遺伝子のプロモーター領域や転写開始点近くに存在することが多く、遺伝子発現の調節に重要な役割を果たします。特に、CpGアイランドと呼ばれるGCリッチ領域は、遺伝子の発現制御において中心的な役割を担っています[14]。CpGアイランドは、少なくとも200塩基対の長さを持ち、GC含量が50%以上で、存在するCpGの割合がGC含量から期待される量の60%以上であると定義されます[14]。これらの領域は、ほとんどのハウスキーピング遺伝子や約40%の組織特異的遺伝子の転写開始点近くに存在し、遺伝子発現の制御に重要な役割を果たしています[15]。
GCリッチ領域のメチル化は、遺伝子発現を抑制することが知られており、特にがん細胞では、がん抑制遺伝子の発現がCpGアイランドの異常なメチル化によって抑制されることがあります[7]。このように、GCリッチ領域は遺伝子発現の調節において重要な役割を果たし、そのメチル化状態は遺伝子の機能に直接影響を与えることがあります。
また、GCリッチ領域は、PCRやDNAシークエンスなどの分子生物学的手法において特別な注意を要する領域でもあります。GCリッチ領域の存在は、PCRの特異的な増幅効率を低下させる可能性があり、特定の添加剤や最適化されたPCR条件が必要になることがあります[8][11]。このように、GCリッチ領域は、遺伝子発現の調節だけでなく、分子生物学的研究においても重要な影響を与える領域です。
- 参考文献・出典
-
[7] ruo.mbl.co.jp/bio/product/epigenome/article/DNA-methylation.html
[8] www.funakoshi.co.jp/contents/67284
[11] www.thermofisher.com/us/en/home/life-science/cloning/cloning-learning-center/invitrogen-school-of-molecular-biology/pcr-education/pcr-reagents-enzymes/pcr-methods.html
[14] ja.wikipedia.org/wiki/CpG%E3%82%A2%E3%82%A4%E3%83%A9%E3%83%B3%E3%83%89
[15] www.dojindo.co.jp/letterj/101/reviews_01.html
GCリッチ領域のPCR増幅における課題
● 高GC含有率によるPCR反応の特異性と効率の低下
GCリッチ領域のPCR増幅は、いくつかの課題を提起します。GC含有率が高いDNAテンプレートは、グアニン(G)塩基とシトシン(C)塩基間の水素結合が強いため、増幅が困難になることがあります。これは、GCリッチ領域が二次構造を形成しやすく、DNAポリメラーゼがテンプレートをスムーズに読み取ることを妨げるためです[5][11][12]。
● GCリッチ領域増幅の際に遭遇する一般的な問題点
1. 二次構造の形成: GCリッチ領域は、特にPCRのアニーリングや伸長段階で二次構造を形成しやすく、プライマーのアニーリングやDNAポリメラーゼによる伸長を阻害することがあります[3][12]。
2. 特異性の低下: GCリッチ領域はプライマーが非特異的に結合しやすく、望ましくない場所でのプライミングやプライマーダイマーの形成を引き起こす可能性があります。これにより、目的のDNA断片ではなく、非特異的な産物が増幅されることがあります[1][4]。
3. 増幅効率の低下: 強固な水素結合により、DNA鎖の分離が困難になり、PCRの増幅効率が低下します。これは、特にデナチュレーションステップでの適切な鎖分離が不十分な場合に顕著です[3][5]。
4. プライマーの設計: GCリッチ領域を含むプライマーの設計は、特異性と効率を確保するために慎重に行う必要があります。プライマーの3’末端には3つ以上のGまたはC塩基を連続させない、Tm値を適切に設定する、GC含有率を40~60%に保つなどの配慮が必要です[1][4][10]。
5. PCR条件の最適化: GCリッチ領域の増幅には、PCR条件の最適化が特に重要です。DMSOやベタインなどの添加剤を使用して二次構造の影響を減少させたり、デナチュレーション温度を高く設定することでDNA鎖の分離を促進することがあります[3][5]。
6. DNAポリメラーゼの選択: GCリッチ領域の増幅には、高いプロセシビティを持つDNAポリメラーゼや、GCリッチ領域に特化したポリメラーゼが推奨されます。これらのポリメラーゼは、強固な水素結合や二次構造による障害を乗り越える能力があります[5][7][13]。
これらの問題点を解決するためには、プライマー設計の最適化、PCR条件の調整、適切なDNAポリメラーゼの選択など、複数のアプローチが必要です。また、PCRのトラブルシューティングにおいては、これらの課題に対処するための具体的な推奨事項が提供されています[7][8]。
- 参考文献・出典
-
[1] www.takara-bio.co.jp/research/prt/pdfs/prt3-1.pdf
[2] www.qiagen.com/jp/resources/download.aspx?id=86cb37aa-32f5-4989-a2aa-c741fdb853fd&lang=ja-JP
[3] dna.brc.riken.jp/ja/manual/technicalnotes12
[4] www.thermofisher.com/us/en/home/life-science/cloning/cloning-learning-center/invitrogen-school-of-molecular-biology/pcr-education/pcr-reagents-enzymes/pcr-component-considerations.html
[5] www.thermofisher.com/us/en/home/life-science/cloning/cloning-learning-center/invitrogen-school-of-molecular-biology/pcr-education/pcr-reagents-enzymes/pcr-methods.html
[6] www.takara-bio.co.jp/research/prt/h1-3b.htm
[7] www.thermofisher.com/jp/ja/home/life-science/cloning/cloning-learning-center/invitrogen-school-of-molecular-biology/pcr-education/pcr-reagents-enzymes/pcr-troubleshooting.html
[8] www.sigmaaldrich.com/US/en/technical-documents/technical-article/genomics/pcr/working-with-pcr
[9] www.kanazawa-med.ac.jp/~kansen/situmon2/semi-nested-pcr.html
[10] www.aandt.co.jp/jpn/medical/tree/vol_12/
[11] www.aandt.co.jp/jpn/medical/tree/vol_13_2/
[12] www.jstage.jst.go.jp/article/jjsth/12/3/12_3_187/_pdf
[13] www.aandt.co.jp/jpn/medical/tree/vol_13_1/
第2章: PCR増幅の基本と最適化
PCR増幅の基礎
● PCRの基本プロセスと増幅メカニズム
ポリメラーゼ連鎖反応(PCR)は、特定のDNA領域を選択的に増幅する技術です。このプロセスは、主に3つのステップで構成されます:変性、アニーリング、そして伸長[3]。
1. 変性: PCRサイクルの最初のステップでは、二本鎖のDNAテンプレートを加熱して分離させ、一本鎖のDNAにします。このプロセスは、通常94~96℃で行われます[3][12]。
2. アニーリング: 次に、温度を下げて(通常55~60℃)、プライマーが一本鎖DNAに特異的に結合することを可能にします。プライマーは、増幅したいDNA領域の両端に相補的な短いDNA配列です[3][12]。
3. 伸長: 最後に、DNAポリメラーゼがプライマーに結合し、新しいDNA鎖を合成します。このステップは、通常72~74℃で行われます[3][12]。
これらのステップは、目的のDNA領域を指数関数的に増幅するために、20~30サイクル繰り返されます[12]。
● PCR反応のための基本的な材料と条件
PCR反応には、以下の基本的な材料が必要です[2][3][4][12]:
– DNAテンプレート: 増幅したいDNA領域を含むサンプル。ゲノムDNA(gDNA)、補完DNA(cDNA)、またはプラスミドDNAが使用されます。
– プライマー: 増幅対象のDNA領域の両端に特異的に結合する短いDNA配列。通常、15~30塩基長です。
– DNAポリメラーゼ: DNA鎖を合成する酵素。Taq DNAポリメラーゼが最も一般的に使用されますが、特殊な要件に応じて他のポリメラーゼも使用されます[2][4]。
– デオキシヌクレオチド三リン酸(dNTPs): DNA鎖の合成に必要な塩基の材料。
– バッファー溶液: 酵素が最適な条件で機能するためのpHと塩濃度を提供します。
– マグネシウムイオン(Mg2+): DNAポリメラーゼの活性を助ける共因子です。
PCRの成功は、これらの材料の質と正確な量、および反応条件(温度サイクル、プライマーの設計、テンプレートDNAの純度など)に大きく依存します[2][3][4][12]。PCRのセットアップと実行には、これらの要素を慎重に最適化することが重要です。
- 参考文献・出典
-
[1] www.thermofisher.com/us/en/home/life-science/cloning/cloning-learning-center/invitrogen-school-of-molecular-biology/pcr-education/pcr-reagents-enzymes/pcr-methods.html
[2] www.thermofisher.com/us/en/home/life-science/cloning/cloning-learning-center/invitrogen-school-of-molecular-biology/pcr-education/pcr-reagents-enzymes/pcr-component-considerations.html
[3] www.thermofisher.com/us/en/home/life-science/cloning/cloning-learning-center/invitrogen-school-of-molecular-biology/pcr-education/pcr-reagents-enzymes/pcr-basics.html
[4] www.sigmaaldrich.com/US/en/technical-documents/protocol/genomics/pcr/standard-pcr
[5] www.jstage.jst.go.jp/article/iwateshigakukaishi/19/1/19_10/_pdf/-char/ja
[6] www.nippongene.com/siyaku/product/pcr/cat_pcr.pdf
[7] blog.takara-bio.co.jp/PCR/pcr_genri
[8] www.pref.kanagawa.jp/sys/eiken/002_kensa/02_gene/200626_pcr.html
[9] www.takara-bio.co.jp/research/prt/pdfs/prt1-1.pdf
[10] www.try-it.jp/chapters-15090/sections-15160/lessons-15161/point-3/
[11] m-hub.jp/biology/1898/105
[12] m-hub.jp/biology/4097/316
[13] www.aandt.co.jp/jpn/medical/tree/vol_12/
GCリッチ領域の増幅の最適化
## 高GC含有率DNAの効率的な増幅のための条件調整
高GC含有率DNAのPCR増幅は、その安定した二次構造と高い融解温度のために困難であることが知られています。この問題を解決するために、特定のポリメラーゼの選択とアドオンリージェントの使用が推奨されます。
● 特定のポリメラーゼの選択
– OneTaq DNA Polymerase: NEBによると、OneTaq DNA Polymeraseは標準PCRおよびGCリッチターゲット用の2種類のバッファーが付属しており、GC含有率が約65%までのターゲットの増幅を強化します。さらに高いGC含有率の場合は、OneTaqに付属の高GCエンハンサーをGCバッファーに追加することで増幅を改善できます[2]。
– Q5 High-Fidelity DNA Polymerase: NEBはまた、Q5 High-Fidelity DNA Polymeraseが高GC含有率ターゲットにも適しているとしています。Q5を使用する際は、通常のTaqベースの製品よりもやや高いアニーリング温度を推奨しており、これがQ5が他の酵素が失敗する場所で成功する理由の一つです。Q5 High GC Enhancerの追加により、GC含有率が85%までのターゲットの増幅が大幅に改善されます[2]。
● アドオンリージェントの使用
– DMSO: DMSOはGCリッチ領域の二次構造を緩和し、増幅を容易にすることが知られています。しかし、DMSOの濃度は最適化が必要であり、活性を50%まで低下させる可能性があるため、慎重に使用する必要があります[10]。
– Betaine: BetaineはGCリッチDNAの増幅においても有効であり、二次構造の形成を防ぎ、増幅を促進します。特に、N4-methyl-2′-deoxycytidine 5′-triphosphate (N4me-dCTP)と組み合わせることで、高GC含有率領域の増幅が改善されることが示されています[11]。
– エチレングリコールと1,2-プロパンジオール: これらのリージェントは、GCリッチDNAの増幅においてbetaineよりも効果的であることが示されています。特に、エチレングリコールまたは1,2-プロパンジオールを使用することで、betaineでは増幅に失敗したGCリッチ領域の増幅に成功した例が報告されています[1]。
● 総括
高GC含有率DNAの効率的な増幅には、適切なポリメラーゼの選択とアドオンリージェントの使用が重要です。OneTaq DNA PolymeraseやQ5 High-Fidelity DNA Polymeraseのような特定のポリメラーゼは、GCリッチターゲットの増幅に特化しており、DMSO、Betaine、エチレングリコール、1,2-プロパンジオールなどのアドオンリージェントの使用により、増幅の成功率をさらに高めることができます。これらの戦略を適切に組み合わせることで、高GC含有率DNAの増幅の最適化が可能となります。
第3章: 高GC含有率DNAの効率的な増幅法
特殊ポリメラーゼと補助材料
● 特殊ポリメラーゼ
GCリッチ領域向けに開発された特殊ポリメラーゼは、GC含量が高いDNA領域の増幅において、二次構造の形成やプライマーの不適切な結合を防ぎ、PCRの効率と特異性を向上させるために設計されています。これらのポリメラーゼは、高いGC含量のDNA領域においても安定した増幅を行うことができる特性を持っています。
例えば、タカラバイオのTks Gflex™ DNA Polymeraseは、ATリッチやGCリッチな領域を含むすべてのターゲットでシングルバンドの増幅産物を得ることができるとされています[1]。また、QIAGENのTopTaq™ DNA Polymeraseは、室温でプライマーやテンプレートへの結合が制限されるため、非特異的な増幅を回避しながら即座に反応セットアップが可能です[3]。
● 効率を向上させる補助材料
PCRの効率を向上させるためには、DMSO(Dimethyl sulfoxide)やBetaine(N,N,N-trimethylglycine)などの補助材料が使用されます。これらの添加剤は、GCリッチ領域の二次構造を解きほぐし、プライマーのアニーリングを促進し、PCRの特異性と収量を向上させる効果があります。
DMSOは、DNAの二次構造の解離やテンプレートの融解温度の低下を促進し、DNAポリメラーゼのアクセスを容易にすることでPCRの成功率を高めることが知られています[3][6][7][9]。一方、Betaineは、ポリヌクレオチド内やポリヌクレオチド間におけるG-C間の結合エネルギーをA-T間の結合エネルギーまで低下させる効果があり、ハイブリダイゼーション効率の改善に寄与します[2]。
これらの添加剤は、PCR反応においてGCリッチな領域の増幅を行う際に特に有効であり、多くの研究でその効果が報告されています。例えば、5% DMSOを添加した場合に最高のPCR成功率が観察されたという研究結果があります[6]。また、BioStab PCR Optimizerは、GCリッチなDNA標的に作用し、PCRの特異的な増幅効率を向上させる製品であり、ATペアには影響を与えずに目的配列のPCR増幅効率を向上させるとされています[11]。
これらの特殊ポリメラーゼと補助材料の使用により、GCリッチ領域のPCR増幅における課題を克服し、より効率的で特異的な増幅を実現することが可能になります。
- 参考文献・出典
-
[1] catalog.takara-bio.co.jp/CONTENTS/catalog_request/pdf/pcr_enz.pdf
[2] www.pref.chiba.lg.jp/sanken/kenkyuu/library/h18/documents/citri04-p15-3pp.pdf
[3] www.qiagen.com/jp/resources/download.aspx?id=86cb37aa-32f5-4989-a2aa-c741fdb853fd&lang=ja-JP
[4] www.sigmaaldrich.com/US/en/technical-documents/technical-article/genomics/pcr/working-with-pcr
[5] dna.brc.riken.jp/ja/manual/technicalnotes12
[6] pubmed.ncbi.nlm.nih.gov/32433893/
[7] www.thermofisher.com/us/en/home/life-science/cloning/cloning-learning-center/invitrogen-school-of-molecular-biology/pcr-education/pcr-reagents-enzymes/pcr-cycling-considerations.html
[8] www.thermofisher.com/us/en/home/life-science/cloning/cloning-learning-center/invitrogen-school-of-molecular-biology/pcr-education/pcr-reagents-enzymes/pcr-methods.html
[9] pubmed.ncbi.nlm.nih.gov/20552011/
[10] www.thermofisher.com/us/en/home/life-science/cloning/cloning-learning-center/invitrogen-school-of-molecular-biology/pcr-education/pcr-reagents-enzymes/pcr-component-considerations.html
[11] www.funakoshi.co.jp/contents/67284
[12] www.aandt.co.jp/jpn/medical/tree/vol_12/
[13] www.aandt.co.jp/jpn/medical/tree/vol_13_2/
[14] www.sigmaaldrich.com/JP/ja/technical-documents/technical-article/genomics/pcr/gc-rich-pcr-system
実験プロトコルとトラブルシューティング
GCリッチ領域のPCR増幅は、その高いGC含量により、DNA二重鎖の熱安定性が高くなり、通常のPCR条件下では適切なデナチュレーションやプライマーのアニーリングが困難になることがあります。このような領域の増幅には、特定の戦略とトラブルシューティングが必要です。
♦ 実験プロトコル
● 1. ポリメラーゼの選択
GCリッチ領域の増幅には、高いプロセシビティとGCリッチ領域に対する特化したポリメラーゼが推奨されます。例えば、ThermoFisherのAccuPrime™ GC-Rich DNA PolymeraseやNEBのOneTaq® DNA Polymeraseがあります[1][2]。
● 2. PCR反応条件の最適化
– アディティブの使用: PCR反応にDMSO、ベタイン、またはグリセロールを添加することで、GCリッチ領域の二次構造の形成を抑制し、デナチュレーションを促進します[1][2][9]。
– アニーリング温度の調整: GCリッチ領域では、アニーリング温度を通常よりも高く設定することが有効です。また、タッチダウンPCRを行うことで、特異性を高めることができます[2][9]。
– 拡張時間の延長: GCリッチ領域の増幅では、DNAポリメラーゼが二次構造を通過するのに時間がかかるため、拡張時間を延長することが推奨されます[2]。
● 3. 特殊なPCR法の利用
– Slowdown PCR: 7-deaza-2′-deoxyguanosineをPCR混合物に添加し、サイクリングプロトコルの温度を変化させることで、GCリッチ領域の成功率を高めることができます[3]。
♦ トラブルシューティング
● 問題: 非特異的な増幅産物の生成
– 解決策: アニーリング温度を徐々に上げるタッチダウンPCRを試みる。または、プライマーの設計を見直し、特異性を高める[9][13]。
● 問題: 増幅産物が得られない
– 解決策: PCR反応にアディティブを添加するか、ポリメラーゼの選択を見直す。また、PCRサイクル数を増やしてみる[13][17]。
● 問題: 低い収量
– 解決策: Mg2+の濃度を調整するか、拡張時間を延長してみる。また、GCリッチ領域専用のPCRキットを使用することも検討する[17]。
● 問題: 高い背景ノイズ
– 解決策: PCR産物の精製を行い、未反応のプライマーを除去する。また、プライマーの濃度を調整してみる[19]。
GCリッチ領域のPCR増幅は、適切なポリメラーゼの選択、反応条件の最適化、および特殊なPCR法の利用により、成功率を高めることができます。また、非特異的な増幅や低い収量などの問題に対しては、上記のトラブルシューティングの方法を試みることが有効です。
- 参考文献・出典
-
[1] bitesizebio.com/24002/problems-amplifying-gc-rich-regions-problem-solved/
[2] www.neb.com/en-us/nebinspired-blog/four-tips-for-pcr-amplification-of-gc-rich-sequences
[3] www.nature.com/articles/nprot.2008.112
[4] www.ncbi.nlm.nih.gov/pmc/articles/PMC2727727/
[5] www.future-science.com/doi/10.2144/000114457
[6] catalog.takara-bio.co.jp/com/tech_info_detail.php?masterid=M100005115&mode=1&unitid=U100005215
[7] www.ncbi.nlm.nih.gov/pmc/articles/PMC4846334/
[8] www.takara-bio.co.jp/research/prt/pdfs/prt1-2.pdf
[9] cshprotocols.cshlp.org/content/2019/2/pdb.prot095141.short
[10] pubmed.ncbi.nlm.nih.gov/18714299/
[11] www.qiagen.com/jp/resources/download.aspx?id=86cb37aa-32f5-4989-a2aa-c741fdb853fd&lang=ja-JP
[12] www.thermofisher.com/us/en/home/life-science/cloning/cloning-learning-center/invitrogen-school-of-molecular-biology/pcr-education/pcr-reagents-enzymes/pcr-component-considerations.html
[13] www.thermofisher.com/us/en/home/life-science/cloning/cloning-learning-center/invitrogen-school-of-molecular-biology/pcr-education/pcr-reagents-enzymes/pcr-troubleshooting.html
[14] dna.brc.riken.jp/ja/manual/technicalnotes12
[15] www.thermofisher.com/us/en/home/life-science/cloning/cloning-learning-center/invitrogen-school-of-molecular-biology/pcr-education/pcr-reagents-enzymes/pcr-cycling-considerations.html
[16] www.thermofisher.com/us/en/home/life-science/cloning/cloning-learning-center/invitrogen-school-of-molecular-biology/pcr-education/pcr-reagents-enzymes/pcr-methods.html
[17] www.sigmaaldrich.com/US/en/technical-documents/technical-article/genomics/pcr/gc-rich-pcr-system
[18] m-hub.jp/biology/4088/252
[19] eurofinsgenomics.jp/media/29305/seq%E3%83%88%E3%83%A9%E3%83%96%E3%83%AB%E3%82%B7%E3%83%A5%E3%83%BC%E3%83%86%E3%82%A3%E3%83%B3%E3%82%B02014oct.pdf
[20] www.thermofisher.com/jp/ja/home/life-science/cloning/cloning-learning-center/invitrogen-school-of-molecular-biology/pcr-education/pcr-reagents-enzymes/pcr-troubleshooting.html
第4章: PCR増幅効率を最大化する実験的アプローチ
温度プロファイルの調整
GCリッチ領域のPCR増幅は、その高いGC含量により二本鎖DNAの安定性が増すため、一般的なPCR条件では困難を伴うことがあります。この章では、GCリッチPCRの増幅効率を最大化するための実験的アプローチ、特に温度プロファイルの調整に焦点を当てます。
● 温度プロファイルの調整
♣ アニーリング温度の最適化
アニーリング温度は、プライマーがテンプレートDNAに特異的に結合する温度です。GCリッチ領域のPCRでは、アニーリング温度の最適化が特に重要です。一般的に、プライマーの融解温度(Tm)よりも3-5℃低い温度が推奨されますが、GCリッチ領域では、より高いアニーリング温度が必要になる場合があります。これは、GCペアがATペアよりも強い結合を形成するため、プライマーとテンプレートの特異的な結合を促進するためです[4][9][10]。
♣ 延伸温度と時間の調整
延伸ステップでは、DNAポリメラーゼがプライマーを起点として新しいDNA鎖を合成します。GCリッチ領域のPCRでは、延伸温度と時間の調整が重要になります。一般的な延伸温度は72℃ですが、GCリッチ領域では、より高い延伸温度が効果的な場合があります。これは、高いGC含量により形成される二次構造を解消し、DNAポリメラーゼがスムーズに合成を進めることを助けるためです。また、延伸時間も、目的のPCR産物のサイズやGC含量に応じて調整する必要があります。長いPCR産物や高いGC含量の場合は、通常よりも長い延伸時間を設定することが推奨されます[4][9][10]。
● 実験的アプローチの適用
GCリッチPCRの増幅効率を最大化するためには、アニーリング温度と延伸温度の最適化だけでなく、PCR添加剤の使用や特殊なPCRバッファーの選択も有効な戦略となります。例えば、DMSOやベタインのようなPCR添加剤は、GCリッチ領域の二次構造を解消し、増幅効率を向上させることが知られています[4][13]。また、特殊なPCRバッファーを使用することで、アニーリング温度の範囲を広げ、より高い特異性と増幅効率を実現することが可能です[9][10]。
GCリッチ領域のPCR増幅は挑戦的ですが、適切な温度プロファイルの調整と実験的アプローチの適用により、効率的な増幅が可能となります。これにより、GCリッチ領域を含む遺伝子の研究や診断において、より正確で信頼性の高い結果を得ることができます。
- 参考文献・出典
-
[1] dna.brc.riken.jp/ja/manual/technicalnotes12
[2] www.qiagen.com/jp/resources/download.aspx?id=86cb37aa-32f5-4989-a2aa-c741fdb853fd&lang=ja-JP
[3] www.sigmaaldrich.com/US/en/technical-documents/protocol/genomics/pcr/pcr-qpcr-dpcr-assay-design
[4] www.funakoshi.co.jp/contents/67284
[5] www.thermofisher.com/us/en/home/life-science/cloning/cloning-learning-center/invitrogen-school-of-molecular-biology/pcr-education/pcr-reagents-enzymes/pcr-component-considerations.html
[6] patents.google.com/patent/JP2022037145A/ja
[7] catalog.takara-bio.co.jp/product/basic_info.php?unitid=U100004190
[8] sandiegoyuyu.com/index.php/news-2/sandiego-news
[9] www.thermofisher.com/us/en/home/life-science/cloning/cloning-learning-center/invitrogen-school-of-molecular-biology/pcr-education/pcr-reagents-enzymes/pcr-methods.html
[10] www.thermofisher.com/us/en/home/life-science/cloning/cloning-learning-center/invitrogen-school-of-molecular-biology/pcr-education/pcr-reagents-enzymes/pcr-cycling-considerations.html
特殊なPCRプロトコル
GCリッチ領域のPCR増幅は、高いGC含量による二本鎖DNAの安定性の増加と、特異的なプライミングの困難さにより、一般的なPCR条件下では挑戦的です。この章では、GCリッチ領域のPCR増幅効率を最大化するための特殊なプロトコルに焦点を当て、2ステップPCRと3ステップPCRの比較を行います。
● 特殊なPCRプロトコル
GCリッチ領域のPCR増幅においては、標準的なPCRプロトコルを修正することで増幅効率を向上させることが可能です。これには、変性条件の最適化、アニーリング温度の調整、特殊な添加剤の使用が含まれます。
1. 変性条件の最適化: GCリッチ領域のPCRでは、変性ステップを98℃で10秒間行うことが推奨されます。これは、GCリッチ領域の高い融点を考慮して、DNA二本鎖の完全な変性を促進するためです[15]。
2. アニーリング温度の調整: プライマーのTm値より2~3℃低い温度をアニーリングのために設定することが一般的ですが、GCリッチ領域では、アニーリング温度をさらに低く設定することが有効な場合があります[17]。
3. 特殊な添加剤の使用: DMSOやベタインのような特殊な添加剤をPCR反応液に加えることで、GCリッチ領域の増幅効率を向上させることができます。これらの添加剤は、GCリッチ領域の二本鎖DNAの安定性を低下させ、特異的プライミングおよび増幅効率の増加をもたらします[16]。
● 2ステップPCRと3ステップPCRの比較
GCリッチ領域のPCR増幅において、2ステップPCRと3ステップPCRのどちらを選択するかは、目的のDNA領域の特性と実験の目的によって異なります。
– 2ステップPCR: アニーリングと伸長ステップを組み合わせたプロトコルです。この方法は、短い増幅産物や時間効率を重視する場合に適しています。GCリッチ領域のPCRでは、2ステップPCRを採用することで、プロセスの簡素化と時間の短縮が期待できます[15]。
– 3ステップPCR: 熱変性、アニーリング、伸長の3つのステップを個別に行うプロトコルです。この方法は、特にGCリッチ領域のように複雑なテンプレートを扱う場合に、各ステップの条件を細かく調整することが可能であり、増幅効率と特異性の向上が期待できます[13]。
● GCリッチ領域向けの特殊プロトコルの適用
GCリッチ領域のPCR増幅においては、特殊プロトコルの適用が効果的です。これには、変性条件の最適化、アニーリング温度の調整、特殊な添加剤の使用が含まれます。また、2ステップPCRと3ステップPCRの選択は、目的のDNA領域の特性と実験の目的に応じて行うことが重要です。これらのアプローチを適切に組み合わせることで、GCリッチ領域のPCR増幅効率を最大化することが可能になります。
- 参考文献・出典
-
[12] www.sigmaaldrich.com/US/en/technical-documents/technical-article/genomics/pcr/working-with-pcr
[13] m-hub.jp/biology/1898/105
[14] www.genewiz.com/ja-JP/Public/Services/Sanger-Sequencing/Difficult-Template-Sequencing?sc_device=Mobile
[15] www.thermofisher.com/blog/learning-at-the-bench/gcrich-pcr/
[16] www.aandt.co.jp/jpn/medical/tree/vol_13_2/
[17] www.aandt.co.jp/jpn/medical/tree/vol_12/
第5章: 研究と開発におけるGCリッチ領域の重要性
GCリッチ領域の遺伝子研究への応用
GCリッチ領域は、ゲノム内でグアニン(G)とシトシン(C)の含量が高い領域を指し、これらの領域は遺伝子の発現調節や遺伝子の安定性に重要な役割を果たしています。GCリッチ領域の研究は、新たな遺伝子の発見や遺伝子機能解析において重要な応用を持ちます。
● 新たな遺伝子の発見
GCリッチ領域は、プロモーター領域やエンハンサー領域など、遺伝子発現を調節する重要な配列を含むことが多いです。これらの領域の解析により、新たな遺伝子や遺伝子発現調節機構が発見される可能性があります。例えば、ヒトゲノム内のGC含量ドメイン構造の解析により、遺伝子密度や組換え頻度が異なる構造上のみならず、機能上のドメインが明らかにされています[15]。また、GCリッチ領域におけるPCR効率向上の試みにより、これまで検出が困難だった遺伝子領域の解析が可能になり、新たな遺伝子や遺伝子変異の発見につながることが期待されます[16]。
● 遺伝子機能解析における役割
GCリッチ領域は、遺伝子の発現調節において重要な役割を果たします。特に、転写因子のプロモーター領域に特徴的なGCリッチ配列の部分に対し、特異的に結合してその発現を抑制する機構が存在します[18]。このようなGCリッチ領域の解析により、遺伝子の発現調節機構の理解が深まり、遺伝子の機能解析において重要な情報を提供します。また、GCリッチ領域は、遺伝子の安定性やmRNAの構造にも影響を及ぼすため、遺伝子の機能解析において考慮すべき重要な要素です。
● まとめ
GCリッチ領域の研究は、新たな遺伝子の発見や遺伝子機能解析において重要な応用を持ちます。遺伝子発現調節機構の解明や遺伝子の安定性に関する研究において、GCリッチ領域は重要な役割を果たしています。今後もGCリッチ領域の詳細な解析により、遺伝学や分子生物学の分野における新たな知見が期待されます。
PCR増幅技術の進展と将来展望
PCR(Polymerase Chain Reaction、ポリメラーゼ連鎖反応)技術は、1983年にKary Mullisによって発明されて以来、分子生物学の分野で革命を起こしました。この技術は、特定のDNA領域を数時間で数百万倍にまで増幅する能力を持ち、疾患の診断、遺伝的変異の検出、犯罪捜査、生物学的研究など幅広い分野で利用されています[16][20]。
● 最新トレンド
PCR技術の進展には、リアルタイムPCRやデジタルPCR(dPCR)などの新しい形態が含まれます。リアルタイムPCRは、増幅プロセスをリアルタイムでモニタリングし、特定のDNAの量を正確に定量化する能力を持っています。一方、dPCRはさらに高い精度と感度を提供し、サンプル中のDNAまたはRNAの絶対量を定量化することができます[5][14]。
PCR技術の感度を向上させるための研究も進んでいます。例えば、産業技術総合研究所の研究チームは、PCR検査の感度を従来比で約100倍に高める測定装置を開発しました。この技術は、微小液滴中でPCR反応を進め、試料を3次元撮影してDNAの有無を捉えることができます[15]。
● GCリッチ領域の研究への応用
GCリッチ領域は、高いGC含量を持つDNA領域であり、PCR増幅時に特有の課題を提示します。GCリッチ領域は二次構造を形成しやすく、PCR増幅の効率を低下させる可能性があります。この問題に対処するため、特定の添加剤や最適化されたPCR条件が研究されています[18][19]。
● 今後の研究での課題と展望
PCR技術の今後の研究では、以下のような課題と展望が考えられます。
– 感度と特異性の向上: PCR技術の感度と特異性をさらに向上させることで、より少ない量のDNAからも正確な情報を得られるようになることが期待されます。これは、疾患の早期診断や微量な遺伝的変異の検出に貢献する可能性があります。
– 新しいPCRベースの技術の開発: リアルタイムPCRやdPCRのような新しい形態のPCR技術の開発は、研究や診断の精度をさらに高めることが期待されます。
– GCリッチ領域の増幅: GCリッチ領域の効率的な増幅に関する研究は、これらの領域を含む遺伝子の研究や診断において重要です。新しい酵素や添加剤の開発により、これらの領域の増幅効率を向上させることが期待されます。
– ポータブルPCR装置の開発: 現場での迅速な診断や研究に利用できる、小型でポータブルなPCR装置の開発も進んでいます。これにより、研究室以外の場所でも高精度なPCR分析が可能になることが期待されます。
PCR技術は、その発明以来、多大な進歩を遂げてきました。今後も、新しい技術の開発や既存技術の改善により、分子生物学の分野での応用範囲がさらに広がることが期待されます。
- 参考文献・出典
-
[5] straitsresearch.com/jp/report/digital-pcr-market
[14] www.thermofisher.com/blog/learning-at-the-bench/qpcr-history-ts/
[15] newswitch.jp/p/38536
[16] diagnostics.roche.com/jp/ja/article-listing/the-evolution-of-pcr.html
[17] www.thermofisher.com/blog/learning-at-the-bench/invitro_rna_nap_bid_ts_1/
[18] www.funakoshi.co.jp/contents/67284
[19] www.vectorbuilder.jp/tool/gc-content-calculator.html
[20] diagnostics.roche.com/jp/ja/article-listing/history-of-pcr.html








