目次
Eukaryotic translation initiation factor 2 alpha kinasesとは
Eukaryotic Translation Initiation Factor 2 Alpha Kinases(EIF2α Kinases)は、真核生物の翻訳開始因子eIF2のαサブユニットをリン酸化する酵素群です。このリン酸化は、タンパク質合成の初期段階での制御に重要な役割を果たしており、主にストレス応答のメカニズムとして機能します。
● 機能と役割
eIF2はリボソームにアミノ酸tRNAを供給する役割を担い、タンパク質合成の開始段階で非常に重要な因子です。eIF2αがリン酸化されると、eIF2の機能が抑制され、全体的な翻訳(タンパク質合成)が減少します。このような抑制は、細胞がストレス(栄養欠乏、ウイルス感染、酸化ストレス、など)にさらされた際に、エネルギーや資源を節約するために起こります。
● 主要なEIF2α キナーゼ
真核生物には4つの主要なeIF2αキナーゼが存在し、それぞれ異なるストレスシグナルに応答します。
1. PKR(Protein Kinase R)
– 主にウイルス感染時に活性化され、インターフェロン応答に関与。
– ウイルス感染による二本鎖RNAの存在を検出して翻訳を停止し、ウイルスの増殖を防ぎます。
2. PERK(Protein kinase RNA-like Endoplasmic Reticulum Kinase)
– 小胞体(ER)ストレスに応答し、細胞のタンパク質品質管理を助けます。
– 小胞体ストレスにより未折りたたみタンパク質が蓄積すると、PERKが活性化され、翻訳を抑制して小胞体の負荷を軽減します。
3. GCN2(General Control Nonderepressible 2)
– アミノ酸欠乏に応答して活性化され、翻訳を抑制。
– アミノ酸が不足した際にタンパク質合成を抑えることで、アミノ酸の再利用を促進します。
4. HRI(Heme-Regulated Inhibitor)
– ヘム不足などのストレスに応答し、赤血球の成熟に関与。
– ヘムが不足した際、グロビン合成を抑制することで、赤血球の正常な形成と機能を支援します。
● 生理学的重要性
eIF2αキナーゼによる翻訳抑制は、細胞が不利な条件に対処し、生存率を高めるために重要です。これらのキナーゼが適切に機能しないと、異常なタンパク質合成が行われ、細胞障害や疾患の原因となることがあります。例えば、PERKの異常は小胞体ストレス関連疾患、GCN2の異常は栄養応答異常など、さまざまな病態に関係しています。
Eukaryotic translation initiation factor 2 alpha kinasesの構造
Eukaryotic Translation Initiation Factor 2 Alpha Kinases(EIF2α Kinases)の構造は、各キナーゼが異なるストレス応答を引き起こすために特化した領域を持っていますが、全体的な構造の基本的な特徴としては、以下のような共通要素があります。
● 基本構造
EIF2αキナーゼは、二つの主要な領域で構成されています:
1. キナーゼドメイン(Kinase Domain)
– 各eIF2αキナーゼの中心となるドメインで、他のプロテインキナーゼの構造に類似しています。
– ATP結合部位をもち、酵素反応を促進します。
– サブストレートであるeIF2αの特定部位を認識し、リン酸化反応を触媒します。
– 活性部位にはATP結合ポケットがあり、ATPからリン酸基を切り離してターゲットのセリン残基に転移します。
2. ストレス応答センサー領域(Stress-Sensing Domain)
– 各キナーゼの特徴を決定する領域で、異なるストレス条件に応じて特異的な活性化機構を持っています。
– 以下に代表的な各キナーゼの応答領域について説明します:
● 各キナーゼの特徴的構造
1. PKR(Protein Kinase R)
– 二本鎖RNA結合ドメインを含む2つのモジュールを持つ。これにより、ウイルスRNAを認識し、自己活性化し、eIF2αのリン酸化を引き起こします。
– 活性化後は、二本鎖RNAから解離し、eIF2αのリン酸化に関与します。
2. PERK(Protein kinase RNA-like Endoplasmic Reticulum Kinase)
– 小胞体ストレスに応答するため、ER膜にアンカーされています。
– 小胞体内腔のN末端に位置するストレスセンシングドメインは、未折りたたみタンパク質が蓄積すると活性化され、細胞質のキナーゼドメインがeIF2αをリン酸化します。
3. GCN2(General Control Nonderepressible 2)
– tRNA結合領域を持ち、アミノ酸不足時に非アセチル化tRNAと結合し、自己活性化を促進します。
– リボソーム関連のタンパク質であるM1ドメインを介してtRNAを感知するため、リボソームと関連して翻訳の調節が可能です。
4. HRI(Heme-Regulated Inhibitor)
– ヘム結合部位があり、ヘムが不足すると構造変化が起こり活性化されます。
– HRIは赤血球系の細胞で、特にグロビンの適切な生成を制御します。
● 機能的な重要性
これらの領域の相互作用によって、各キナーゼは異なる細胞ストレスに対して迅速かつ適切に応答する能力を持っています。また、キナーゼドメインとストレス応答センサー領域の組み合わせが、各キナーゼの特異性と機能を決定しています。
● 高次構造
多くの場合、eIF2αキナーゼは二量体またはオリゴマーとして機能し、活性化時にサブユニット間での相互作用が生じ、eIF2αへのリン酸基の付加が効率よく行われます。
Eukaryotic translation initiation factor 2 alpha kinasesの機能
Eukaryotic Translation Initiation Factor 2 Alpha Kinases (eIF2α Kinases) は、真核生物のタンパク質合成の開始段階を調節するために働き、特に細胞がストレスに直面したときにその役割が重要になります。これらのキナーゼは、eIF2のαサブユニット(eIF2α)をリン酸化することで、タンパク質合成を減少させ、細胞がエネルギーを節約しつつ、ストレスへの適応を促進します。
1. タンパク質合成の調節
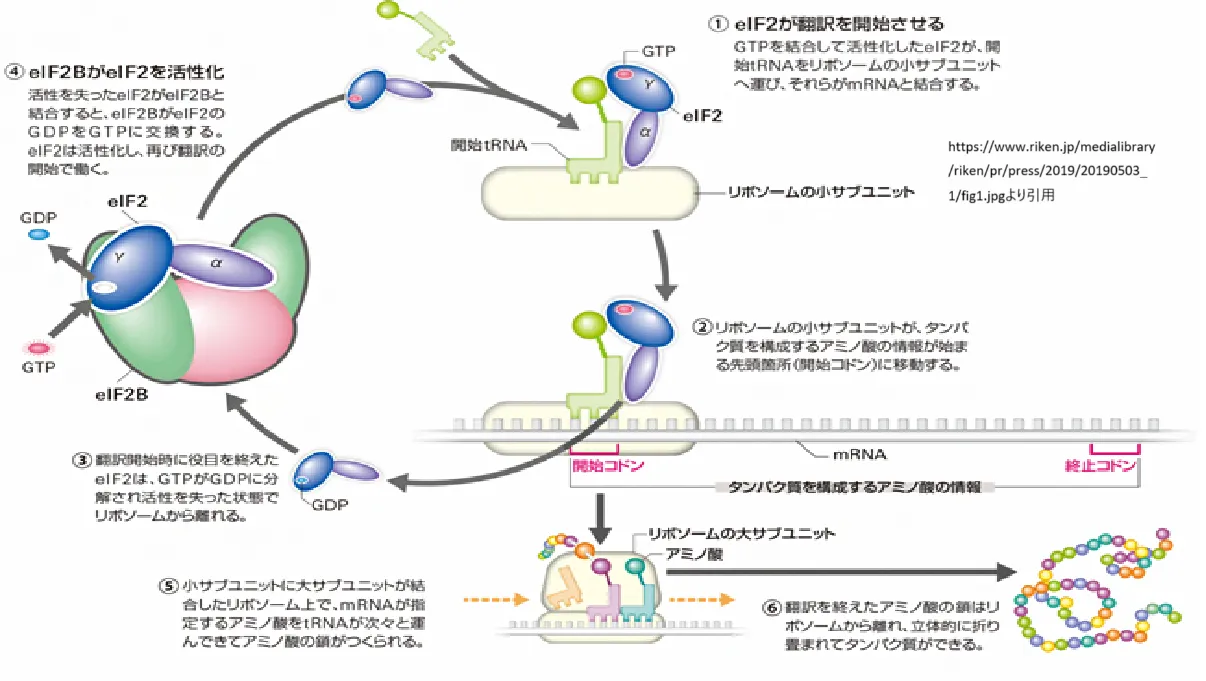
– eIF2は、GTP結合タンパク質であり、開始因子としてアミノ酸tRNAをリボソームに運搬します。
– ストレスがない通常の条件下では、eIF2はGDPからGTPへの再活性化によりタンパク質合成を継続的に行います。
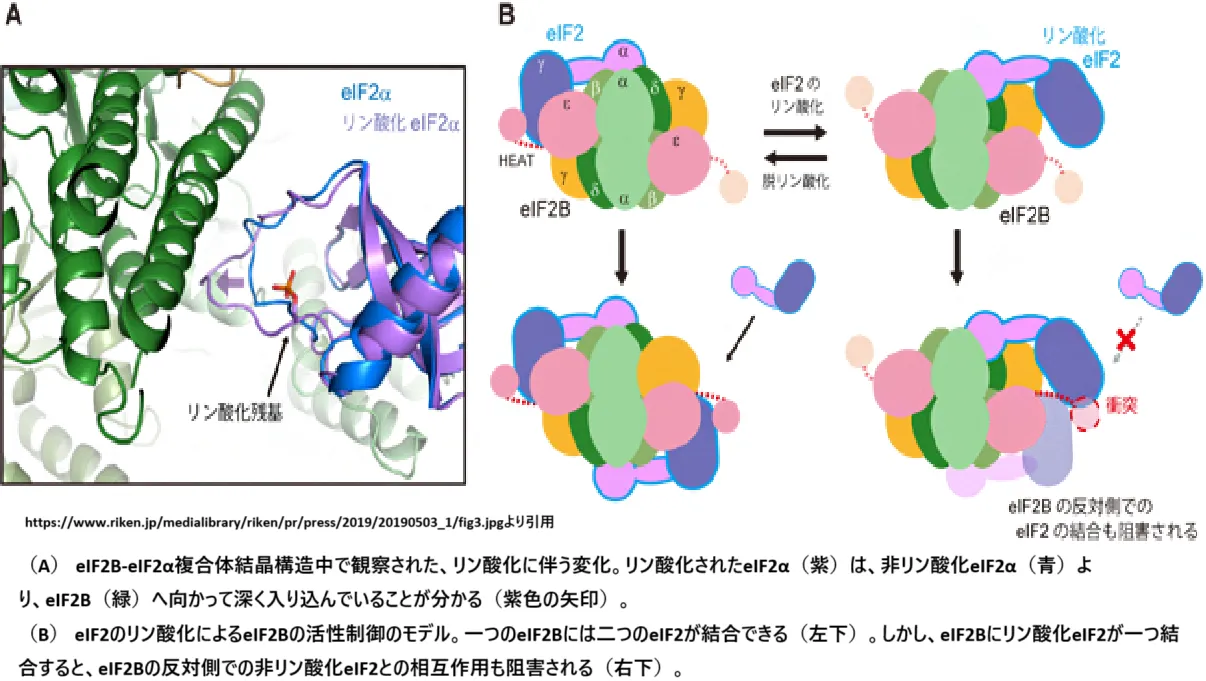
– ストレスに応じてeIF2αキナーゼがeIF2αをリン酸化すると、eIF2Bというグアニンヌクレオチド交換因子がeIF2を再活性化できなくなり、全体的なタンパク質合成が抑制されます。
2. 細胞ストレス応答の促進
– eIF2αキナーゼは、特定の細胞ストレス条件に応答し、それぞれのキナーゼが異なるストレスシグナルに対して活性化されます:
– PKR はウイルス感染によって活性化され、ウイルス由来RNAを認識し、感染制御と抗ウイルス応答を促進します。
– PERK は小胞体ストレス、特に未折りたたみタンパク質の蓄積に応答し、ERストレス応答(UPR)を誘導して細胞の回復を図ります。
– GCN2 はアミノ酸の不足に反応して活性化し、翻訳を抑制しつつ、アミノ酸生合成を促進する遺伝子の発現を調整します。
– HRI はヘム不足により活性化し、赤血球においてグロビンとヘムの生成のバランスを取り、無駄なタンパク質合成を防ぎます。
3. 特定のストレスに対応した遺伝子発現の制御
– eIF2αのリン酸化により、一般的な翻訳は低下しますが、ストレスに関連した特定の遺伝子群の翻訳は逆に促進されます。
– たとえば、ストレス誘導性の転写因子であるATF4は、eIF2αのリン酸化時に選択的に翻訳され、細胞内でストレス応答遺伝子の発現を増強し、細胞の回復と適応を支援します。
4. ストレス適応と細胞生存のサポート
– eIF2αキナーゼによって誘導されるストレス応答は、タンパク質合成のエネルギー消費を一時的に抑えつつ、細胞が修復機構や防御機構にリソースを集中させるように働きます。
– 特に厳しいストレス条件下では、eIF2αキナーゼが持続的に活性化されると、翻訳抑制が進行しすぎることがあります。この際には、アポトーシスが引き起こされ、細胞のプログラムされた死に向かうこともあります。
● まとめ
eIF2αキナーゼは、タンパク質合成の抑制とストレス応答の促進を介して、細胞の生存をサポートし、さまざまなストレス条件下での適応力を高める重要な役割を担っています。
www.google.com/imgres?q=EIF2%CE%B1%E3%80%80%E6%A7%8B%E9%80%A0&imgurl=https%3A%2F%2Fwww.riken.jp%2Fmedialibrary%2Friken%2Fpr%2Fpress%2F2019%2F20190503_1%2Ffig3.jpg&imgrefurl=https%3A%2F%2Fwww.riken.jp%2Fpress%2F2019%2F20190503_1%2F&docid=T9w7GtZnwnJh0M&tbnid=LyRkyhcya7g2ZM&vet=12ahUKEwj7kYm2pLqJAxUQgK8BHYBRIXQQM3oECGMQAA..i&w=650&h=250&hcb=2&ved=2ahUKEwj7kYm2pLqJAxUQgK8BHYBRIXQQM3oECGMQAA
より引用
Eukaryotic translation initiation factor 2 alpha kinasesに属する遺伝子
EIF2AK1
EIF2AK2
EIF2AK3
EIF2AK4