目次
DNA結合ドメイン(DBD)は、タンパク質がDNAと特異的に相互作用するために重要な役割を果たす構造的要素です。これらのドメインは、遺伝子の転写を調節する転写因子や、DNAの修復、複製、およびその他の核酸代謝過程に関与する他のタンパク質に広く存在しています。DBDがDNAに結合する際の特異性は、生物学的プロセスにおける精密な遺伝子制御を可能にします。
● DBDの特徴
– 構造モチーフ: DNA結合ドメインは、特定の構造モチーフを含むことで、二本鎖または一本鎖のDNAに結合します。これらのモチーフには、ヘリックスターンヘリックス、亜鉛指、ルシンジッパー、ヘアピンモチーフなどがあります。各モチーフは、特定の三次元構造を持ち、DNAの特定の塩基配列と相互作用することで、タンパク質が特定のDNA領域を認識できるようにします。
– 認識配列の特異性: 多くのDBDは、特定のDNA配列、しばしば「認識配列」と呼ばれるものを認識します。この特異性により、タンパク質はゲノム内の正確な位置に結合し、特定の遺伝子の活性化または抑制を誘導することができます。
– 一般的な親和性: 一部のDNA結合ドメインは、特定の配列を認識する代わりに、DNAに一般的な親和性を持ちます。これらのDBDは、DNAの形状や柔軟性など、塩基配列以外の特性に基づいてDNAと相互作用することがあります。
– 核酸の含有: いくつかのDBDは、その折り畳み構造内に核酸を含むことが知られています。これにより、タンパク質-DNA相互作用の安定性や特異性がさらに高まることがあります。
● DBDの生物学的重要性
DNA結合ドメインは、生命現象を制御する多くのプロセスにおいて中心的な役割を担います。例えば、転写因子は、DBDを介して特定のプロモーター領域やエンハンサー領域に結合し、遺伝子の発現を調節します。また、DNA修復酵素は、DBDを利用して損傷したDNA領域を認識し、適切な修復メカニズムを起動します。
DBDの研究は、遺伝子調節の基本メカニズムの理解を深めるだけでなく、疾患の原因となる遺伝子調節異常の解明や、遺伝子治療、薬剤開発などの医学的応用に向けた重要な知見を提供します。DNAとの相互作用メカニズムを詳細に理解することで、特定の遺伝子の活性化または抑制を目的とした分子の設計が可能になります。
DNA結合ドメインはどうやってDNAに結合するのか
DNAの二重らせん構造には、主溝(major groove)と副溝(minor groove)と呼ばれる二つの溝が存在します。これらの溝は、DNAの二重らせんを形成する際に、塩基対間の空間的配置によって生じます。タンパク質、特にDNA結合ドメインを持つタンパク質は、これらの溝を介して特定のDNA配列と相互作用し、遺伝子の発現を調節する能力を持っています。
● 主溝と副溝
主溝(Major Groove):
主溝は、DNAの二重らせん構造においてより広く深い溝です。塩基対の側面が主溝に向かって露出しており、アデニン–チミン(A-T)対は2つの水素結合、グアニン–シトシン(G-C)対は3つの水素結合を持ちます。この水素結合のパターンは、主溝の特定の位置で異なり、タンパク質がDNAの塩基配列を「読み取る」ための特異的な化学的手がかりを提供します。そのため、多くのDNA結合タンパク質は主溝を介してDNAと結合し、その塩基配列の特異性を認識します。
副溝(Minor Groove):
副溝は、主溝よりも狭く浅い溝です。副溝は、塩基対の認識には主溝ほど利用されませんが、特定のタイプのタンパク質によっては副溝を介してDNAと相互作用することもあります。副溝を介した相互作用は、一般的には主溝を介した相互作用ほど塩基配列に対して特異的ではありませんが、DNAの形状認識や曲がりやすさの感知に関わることがあります。
● DNA結合ドメインの結合メカニズム
DNA結合ドメインがDNAに結合する際には、主に主溝を介して特定の塩基配列と相互作用します。この結合は、水素結合、疎水相互作用、静電相互作用など、複数の非共有結合力によって仲介されます。DNA結合ドメインの特定のアミノ酸残基が、DNAの塩基の特定の化学的特徴と相互作用し、強い結合特異性を示します。この高度な特異性により、タンパク質はゲノム内の特定の遺伝子領域を正確に識別し、その活性を調節することができます。
DNA結合ドメインとDNAの相互作用は、生命現象における遺伝子の精密な制御メカニズムの根幹をなすものであり、遺伝子の発現、DNA修復、複製など、多岐にわたるプロセスにおいて重要な役割を果たします。
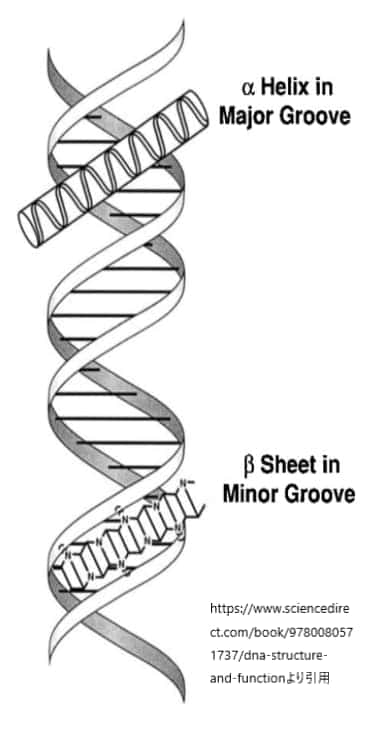
上図はDNAのらせん構造と主溝副溝を示したものです。
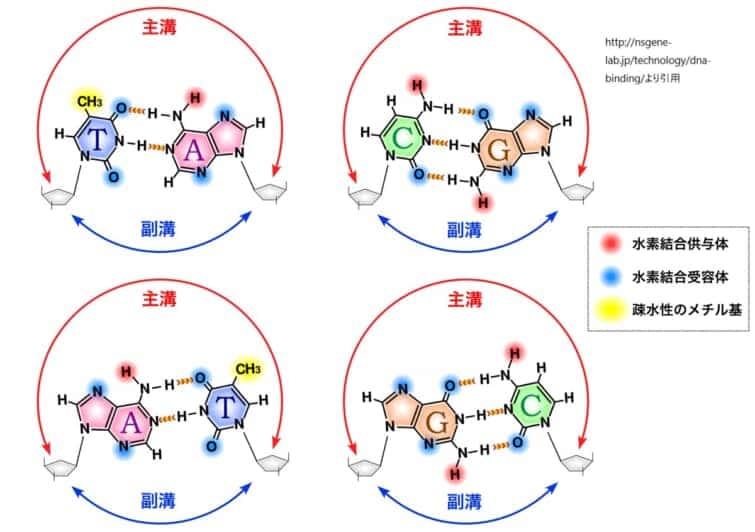
上図は主溝副溝を示したものです。
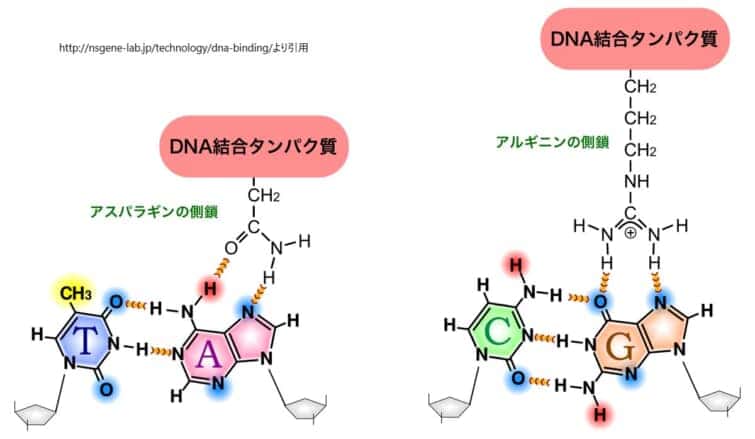
DNAに対するタンパク質の結合メカニズムは、分子間の詳細な相互作用に基づいています。具体的には、タンパク質のDNA結合ドメイン内の特定のアミノ酸側鎖が、DNAの塩基対の特定の化学的特性と結合します。このプロセスは、DNAの主溝を通じて行われ、DNA二重らせん構造を開くことなく、転写因子などのタンパク質が目的のDNA部位に特異的に結合することを可能にします。
● アミノ酸側鎖とDNA塩基対の相互作用
DNA塩基対の親水性や疎水性、水素結合供与能や受容能のパターンは、それぞれ異なります。例えば、アデニン(A)とチミン(T)は2つの水素結合で結びつき、グアニン(G)とシトシン(C)は3つの水素結合で結びつきます。これらの塩基対は、主溝において独自の化学的環境を形成し、タンパク質が特定の塩基配列を識別するための「化学的手がかり」を提供します。
タンパク質のアミノ酸側鎖は、これらの化学的手がかりに対応する様々な機能を持ちます。例えば、アルギニンやリジンの側鎖は正電荷を持ち、DNAの塩基対の負電荷と相互作用します。また、アスパラギンやグルタミンの側鎖は水素結合の供与者または受容者として機能し、特定の塩基対と特異的に相互作用することができます。疎水性の側鎖(例えば、フェニルアラニン)は、DNAの塩基対の疎水性部分と相互作用することもあります。
● 三次元構造の適合性
タンパク質がDNAと特異的に結合するためには、単に化学的な相互作用が適合するだけでなく、タンパク質とDNAの三次元構造の適合性も重要です。タンパク質のDNA結合ドメインは、DNAの主溝にぴったりと収まるように精密に折りたたまれ、特定のDNA配列を「読み取る」ための正確な配置を実現します。この三次元構造の適合性により、転写因子はDNA二重らせん構造を開くことなく、目的のDNA部位に高い特異性で結合することが可能になります。
このようにして、タンパク質はDNAの特定の塩基配列を認識し、遺伝子の発現を制御することができます。この精密な相互作用は、生物学的プロセスの調節において極めて重要であり、遺伝子のオン・オフを正確に制御する基盤を提供します。
DNA結合ドメインの機能
多くのタンパク質は、DNA結合ドメイン(DBD)のほかに、一つまたは複数の追加の機能ドメインを持っています。これらの追加ドメインは、タンパク質のDNA結合能力やその他の機能に重要な影響を与え、タンパク質の活動を調節する役割を果たします。DNA結合ドメインとこれらの追加ドメインが一体となって、タンパク質の多様な生物学的機能を実現しています。
● DNA結合ドメインと追加ドメインの相互作用
活性の制御:
追加のドメインは、DNA結合ドメインの活性を直接的に調節することがあります。例えば、あるドメインがDNA結合ドメインを抑制することにより、タンパク質が特定のDNA配列に結合するタイミングを制御することができます。このような調節は、細胞の状態やシグナル伝達経路の活性化に応じて変化する場合があります。
構造的役割:
一部の追加ドメインは、タンパク質全体の構造的安定性を高めたり、特定の形状を維持するために必要です。これにより、DNA結合ドメインが効率的にDNAにアクセスし、特異的な塩基配列に結合できるようになります。
転写制御の機能:
多くの場合、追加ドメインは転写因子として機能するタンパク質において、転写の活性化または抑制に関与します。これらのドメインは、転写調節因子、共役因子、またはRNAポリメラーゼとの相互作用を介して、遺伝子の発現を調節することができます。
機能の多様性:
複数の機能ドメインを持つタンパク質は、DNA結合だけでなく、プロテイン間相互作用、シグナル伝達、細胞内局在の変更など、さまざまな生物学的プロセスに関与することができます。これにより、タンパク質は複雑な細胞内外のシグナルに応答し、精密な遺伝子調節ネットワークの一部として機能します。
DNA結合ドメインと追加ドメインの組み合わせは、タンパク質が特定の生物学的コンテキストにおいて、多様な機能を果たすための柔軟性を提供します。この多様性は、生命現象の複雑さと精密さを理解する鍵となります。タンパク質の構造と機能の研究は、遺伝子調節のメカニズムを解明し、新しい治療戦略の開発に寄与する可能性があります。
DNA結合ドメイン(DBD)は、タンパク質がDNAと相互作用し、遺伝子の発現、DNAの複製や修復、メチル化などの修飾に生物学的役割を果たすための重要な要素です。これらのドメインを通じて、タンパク質はDNAの特定の配列を認識し、細胞内の遺伝子制御ネットワークの一部として機能します。
● DNA結合ドメインの生物学的役割
– DNAの複製と修復: DNA結合ドメインを持つタンパク質は、DNAの複製過程において複製フォークの形成と進行を助けたり、DNA損傷を認識して修復過程を開始します。
– DNAの修飾: メチル化やその他の化学修飾は、遺伝子の発現を制御するために重要です。特定のDNA配列を認識するDBDを持つ酵素は、これらの修飾を特定の遺伝子領域に追加します。
– 転写の制御: 転写因子は、DBDを介して特定のプロモーターやエンハンサー領域に結合し、遺伝子の発現を調節します。これにより、細胞は環境の変化や発達の過程に応じて、必要なタンパク質を適切な量で生産できます。
● DNA認識のメカニズム
– 配列特異的と非配列特異的な相互作用: 一部のDBDは特定のDNA配列に結合し、遺伝子の活性化や抑制に直接関与します。他のDBDは、非配列特異的な結合を通じてDNAと相互作用し、より一般的なDNA構造の認識やDNA骨格との相互作用を行います。
– DNAの主溝と副溝の認識: DNA長溝は、配列特異的なDNA認識においてより重要な役割を果たします。これは、長溝がより多くの化学的情報を提供し、タンパク質がDNA塩基の詳細な水素結合パターンを読み取ることができるためです。
● DNA結合タンパク質の特異性の研究
DNA結合タンパク質の特異性と機能を研究するためには、多様な生化学的および生物物理学的手法が利用されます。これには、ゲル電気泳動、分析的超遠心分離、熱量測定、核磁気共鳴(NMR)、X線結晶学、表面プラズモン共鳴(SPR)などが含まれます。これらの手法を通じて、研究者はDNAとタンパク質間の相互作用の詳細、DNA結合部位の特定、タンパク質の構造変化、および遺伝子調節におけるその役割を解明します。
DBDを持つタンパク質の研究は、基本的な生物学的プロセスの理解を深めるだけでなく、遺伝子療法、疾患の診断および治療などの医学的応用においても重要な意味を持ちます。DNAとの相互作用を制御する新しい薬剤の開発や、特定の遺伝子の発現を調節する手段の発見につながる可能性があります。
DNA結合ドメインの種類
ヘリックスターンヘリックス
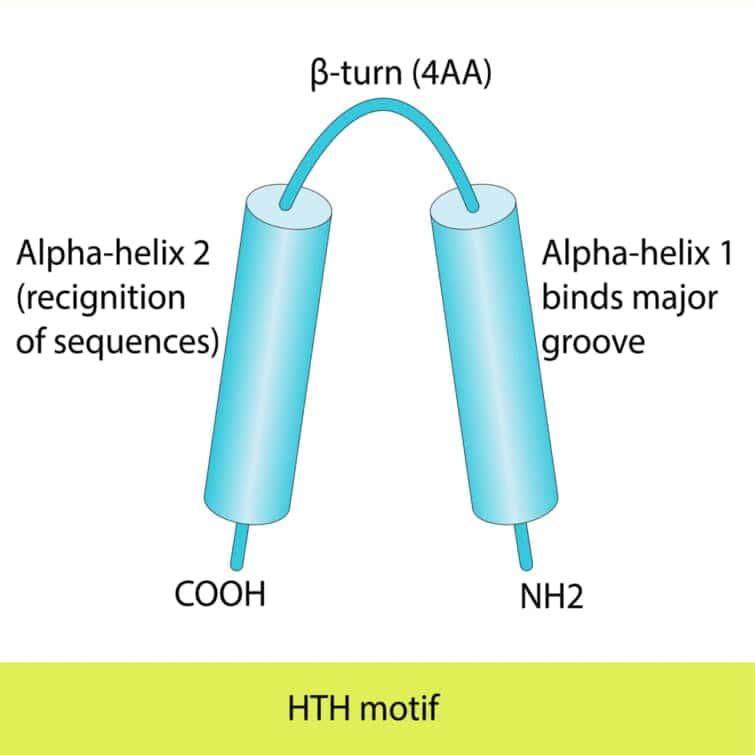
ヘリックス-ターン-ヘリックス(HTH)モチーフは、タンパク質がDNAと結合する際に見られる構造的特徴の一つで、特にDNAを認識し結合する際に重要な役割を果たします。このモチーフは二つのαヘリックスで構成され、その間に短いターンが存在します。HTHモチーフは最初にバクテリアのリプレッサータンパク質で発見されましたが、真核生物の遺伝子発現を制御するタンパク質にも広く存在しています。
● ヘリックス-ターン-ヘリックスの構造と機能
第1ヘリックス(N末側): 第1ヘリックスは、主にDNAの糖-リン酸骨格と接触します。このヘリックスはDNAの主溝の外枠に位置し、タンパク質が特定のDNA配列を認識する際の「アンカー」として機能します。この接触は、主に静電相互作用によって仲介されます。
第2ヘリックス(C末側、認識ヘリックス): 第2ヘリックスは、主溝に適合し、DNAの塩基対と直接的に水素結合を形成します。このヘリックスから突出するアミノ酸側鎖は、特定の塩基配列と相互作用し、タンパク質のDNA結合特異性を決定します。この精密な相互作用により、タンパク質はゲノム内の正確な位置に結合し、遺伝子の発現を調節することができます。
● 真核生物におけるヘリックス-ターン-ヘリックス
真核生物では、ホメオドメインタンパク質がHTHモチーフを含み、これらは主に発生過程を制御する役割を持ちます。ホメオドメインは、HTHモチーフの進化した形態であり、2つのαヘリックスからなりますが、特に第2のヘリックスがDNAの塩基配列と結合する認識ヘリックスとして機能します。
● 生物学的重要性
HTHモチーフおよびホメオドメインは、細胞の運命決定、組織の形成、器官の発達など、生物学的プロセスにおいて極めて重要な役割を担っています。これらのタンパク質ドメインの構造的特徴とDNAとの相互作用メカニズムの理解は、遺伝子発現の精密な調節メカニズムの解明に貢献し、遺伝病や発達障害の治療戦略の開発につながる可能性があります。
ジンクフィンガー zinc finger
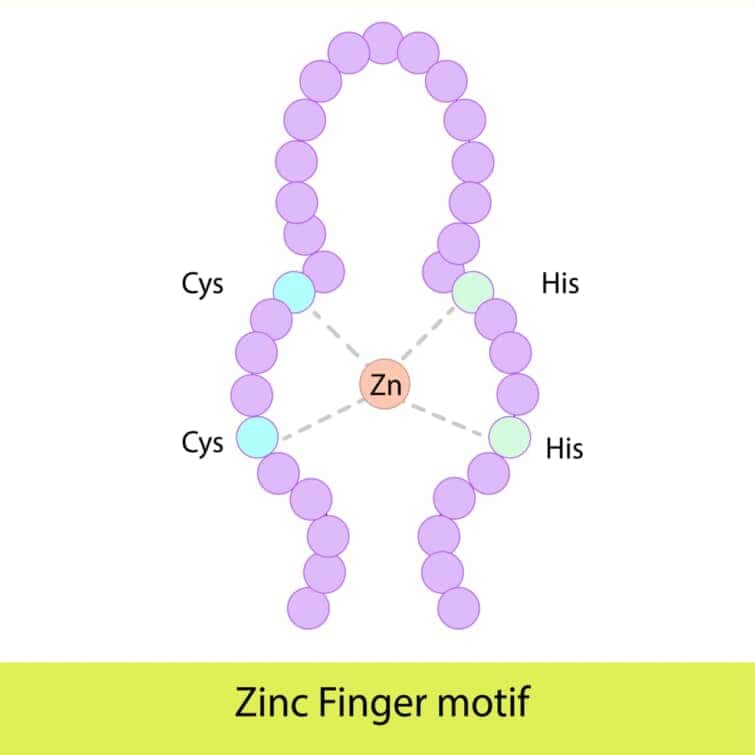
ジンクフィンガードメインは、タンパク質がDNA、RNA、あるいは他のタンパク質と特異的に結合するための構造モチーフの一つです。このドメインは、亜鉛イオンを結合することでその構造を安定化させ、タンパク質に特定の生物学的機能を与えます。ジンクフィンガーは多様な生物に存在し、特に真核生物の転写因子に広く見られますが、バクテリアにも存在することが知られています。
● ジンクフィンガードメインの構造
ジンクフィンガードメインの長さは一般に23から28アミノ酸で、一つまたは複数の亜鉛イオンをその構造の中心に持ちます。最も一般的なタイプのジンクフィンガー、Cys2His2型では、一つの亜鉛イオンが2つのシステイン残基と2つのヒスチジン残基によって配位されます。この配置により、タンパク質は特定の三次元構造、特にαヘリックス(認識ヘリックス)とβシート(2ストランドのβシート)を形成します。
● DNAとの相互作用
ジンクフィンガードメインのDNAとの結合は主に認識ヘリックスを介して行われます。このヘリックスがDNAの主溝に挿入され、特定の塩基配列と水素結合や他の種類の相互作用を形成します。転写因子などのタンパク質において、複数のジンクフィンガードメインがしばしば連続して存在し、短いリンカー配列によって互いに結合しています。これらの連続するジンクフィンガーは、DNA上で隣接するフィンガーが約3ベースペアの間隔で特定のDNA配列に結合するように配置されます。
● 生物学的役割
ジンクフィンガードメインを含むタンパク質は、遺伝子の転写の制御において中心的な役割を果たします。これらのドメインを持つ転写因子は、特定のプロモーター領域やエンハンサー領域に結合し、遺伝子の発現を調節することができます。ジンクフィンガードメインはまた、DNA修復や複製、タンパク質間相互作用、細胞シグナリングなど、他の多くの生物学的プロセスにも関与しています。
ジンクフィンガードメインの研究は、その機能的多様性と、遺伝子発現の精密な制御におけるその重要性を明らかにしています。また、ジンクフィンガーを持つタンパク質の構造と機能の詳細な理解は、遺伝子療法や疾患治療における新しい戦略の開発に貢献する可能性があります。
ロイシン・ジッパー Leucine zipper
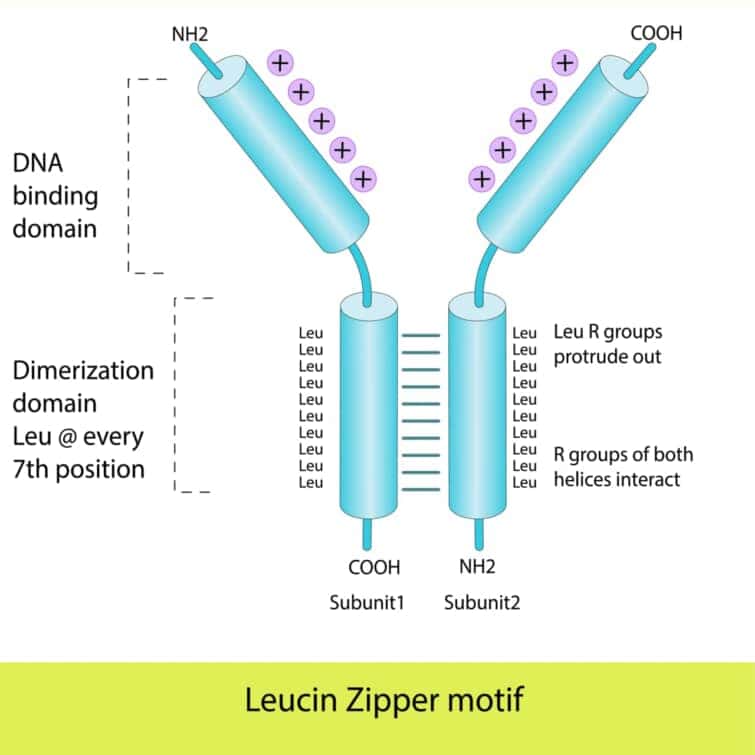
ベーシックロイシンジッパー(bZIP)ドメインは、転写因子に見られる一般的なDNA結合ドメインの一つで、その名前は、基本的(ベーシック)な性質を持つアミノ酸領域と、ロイシンジッパー構造に由来します。このドメインは、特に真核生物の転写因子に広く見られますが、バクテリアではその存在が限られています。bZIPドメインを持つタンパク質は、遺伝子の発現を制御する重要な役割を果たします。
● bZIPドメインの構造
bZIPドメインは、特徴的なαヘリックス構造を持ち、その一部に7つのアミノ酸ごとにロイシン残基が配置されるロイシンジッパー構造が含まれます。このロイシンジッパー構造は、タンパク質の二量体形成に寄与し、2つのαヘリックスがジッパーのように結合します。これにより、タンパク質は安定した二量体を形成し、DNAに対してより強い結合能を持つようになります。
bZIPドメインには、DNA結合に直接関与する基本的なアミノ酸領域も存在し、この領域のアミノ酸はDNAの主溝に挿入し、特定の塩基配列と相互作用します。ロイシンジッパー構造の先端に位置するヘリックスの一方が、このDNA認識機能を担う認識ヘリックスとして機能します。
● 遺伝子発現の制御
bZIPドメインを持つ転写因子は、DNAの特定の配列に結合することにより、遺伝子の転写を調節します。これらの転写因子は、遺伝子のプロモーターやエンハンサー領域に特異的に結合し、RNAポリメラーゼのリクルートメントを促進したり、遺伝子の転写を抑制したりすることができます。
bZIPタンパク質は、細胞の応答、発達プロセス、細胞周期制御、およびストレス応答など、多くの生物学的プロセスに関与しています。このドメインを含む転写因子は、細胞内外のさまざまなシグナルに応じて遺伝子の発現パターンを調節し、細胞の適応能力を高めます。
● まとめ
ベーシックロイシンジッパー(bZIP)ドメインは、転写因子のDNA結合能力と遺伝子発現の制御メカニズムにおいて重要な役割を果たします。このドメインを介した複雑な遺伝子制御ネットワークの理解は、基礎生物学だけでなく、疾患の治療戦略の開発にも重要な影響を与えます。
ヘリックス-ループ-ヘリックス helix-loop-helix
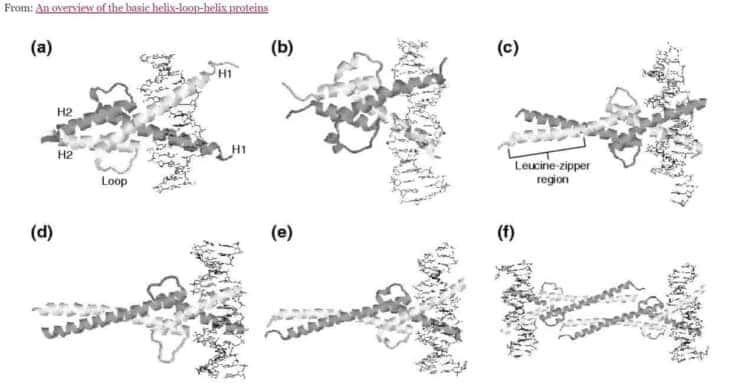
Protein Data Bankに掲載されているbHLHタンパク質の代表的な構造。各図では、タンパク質は二次構造の漫画で、DNAの二重らせんは棒グラフで示されている。(a) MyoDのbHLHドメインのホモダイマー(PDBコード1mdy)。(b) Pho4 bHLHドメインのホモ二量体 (1am9) (c) SREBP-1a bHLHドメインのホモ二量体 (1aoaC) (d) Max-Madヘテロ二量体(1nlw)。(e)Max-Mycヘテロ二量体(1nkp)。f)Max-Mycヘテロテトラマー(1nkp)。(d-f)では、Max HLH単量体を濃い灰色で示した。縮尺は異なる構造間で比較することはできない。
ベーシックヘリックス-ループ-ヘリックス(bHLH)ドメインを持つタンパク質は、転写調節因子として広範な生物学的機能を果たす大規模なスーパーファミリーを形成しています。これらのタンパク質は、酵母からヒトまで幅広い生物に見られ、性決定、神経系や筋肉の発達など、発生過程の重要な段階で活動します。
● bHLHドメインの特徴
bHLHドメインは、二つのαヘリックスがループで結ばれた構造を持ちます。一般に、このドメインを含む転写因子は二量体を形成し、その活動において二量体化は重要な役割を果たします。二量体化は、一方のヘリックスが小さく、ループの柔軟性によってもう一方のヘリックスに対して折り畳まれてパッキングされることによって可能になります。
– DNA結合: 大きい方のヘリックスには通常、DNA結合領域が含まれており、塩基性アミノ酸残基を持つことが多いです。このヘリックスがDNAの主溝に挿入し、特定の塩基配列と結合します。
– HLHドメイン: bHLHタンパク質の多くは、HLHドメインに隣接して約15アミノ酸の余分な塩基性領域を持ち、この領域がDNAと特異的に結合します。
– E-boxモチーフ: bHLHファミリーのタンパク質は、E-boxと呼ばれるコア配列「CANNTG」に結合します。この特異的なDNA結合は、タンパク質が特定の遺伝子の転写を調節するための基盤となります。
● bHLHタンパク質の機能
bHLHタンパク質は、ホモまたはヘテロ二量体を形成し、DNA結合と転写活性化、または転写抑制のいずれかに関与します。基本ドメインを持たないHLHタンパク質(例:Emc, Id)は、ヘテロ二量体を形成しますが、DNAには結合せず、代わりに他の転写因子の活動を抑制することでネガティブレギュレーターとして機能します。
また、hairy関連タンパク質のようにDNAに結合できるが転写を抑制するタンパク質も存在し、これらは共同リプレッサータンパク質と協働して転写を抑制します。
● 結論
bHLHドメインを持つ転写因子は、生物学的多様性と複雑性の源泉であり、発生、分化、組織特異的な機能の維持など、生命現象の基礎を形成しています。これらのタンパク質の精密な制御は、健康と疾患のコンテキストの両方で極めて重要です。
HMG-box
HMG-box(High Mobility Group box)ドメインは、高移動度グループ(HMG)タンパク質に見られるDNA結合ドメインです。このドメインは、DNAの複製、転写、修復など、多様なDNA依存性プロセスに関与しています。特に、DNAの構造的な柔軟性を変化させる能力があり、DNAに屈曲を誘導することで特定の生物学的プロセスを促進することが知られています。
● HMG-boxドメインの構造
HMG-boxドメインは、一般にループで区切られた3つのαヘリックスから構成されています。この構造により、ドメインはDNAのマイナーグルーヴに結合し、DNAのベンディング(屈曲)を促進することができます。DNAとの結合においては、HMG-boxドメインは特定の塩基配列に対して高い特異性を持つわけではなく、むしろDNAの形状や曲がりやすさに応じて結合することが特徴です。
● HMG-boxドメインの機能
– DNAの柔軟性の変化: HMG-boxドメインを持つタンパク質は、DNAのベンディングを促進することでDNAの構造的な柔軟性を変化させます。これにより、転写因子の結合サイトが露出したり、DNAの複製や修復のための酵素がアクセスしやすくなったりします。
– 転写の促進: HMG-boxドメインを持つタンパク質は、転写の開始点近くでDNAの屈曲を誘導することにより、転写因子やRNAポリメラーゼの結合を促進し、転写を活性化します。
– DNA修復と複製: このドメインは、DNAの修復や複製プロセスにも関与しています。DNA損傷部位の認識や複製フォークの進行を助けることで、細胞の遺伝物質の正確な複製と維持に貢献します。
● まとめ
HMG-boxドメインは、その独特の構造と機能により、細胞のDNA依存性プロセスに広範な影響を与える重要なタンパク質ドメインです。DNAの構造的な柔軟性を調節することにより、転写の調節、DNA修復、および複製など、細胞の基本的な機能をサポートしています。HMG-boxドメインの詳細な研究は、これらの生物学的プロセスのメカニズムを解明し、遺伝子発現の調節やDNA損傷応答など、多くの疾患の治療に関連する新しい治療標的を提供する可能性があります。
Wor3ドメイン
Wor3ドメインは、特定の真菌種、特にカンジダ・アルビカンス(Candida albicans)に見られる比較的新しいDNA結合ドメインです。このドメインは、White-Opaque Regulator 3(Wor3)タンパク質にちなんで名付けられ、真菌の遺伝子発現の調節に重要な役割を果たします。Wor3は、カンジダ・アルビカンスにおける白色-不透明(white-opaque)の遷移を調節する因子の一つであり、この遷移は菌の病原性や生殖に関連しています。
● Wor3ドメインの特徴と重要性
– 進化的新規性: Wor3ドメインは、進化の過程で比較的最近出現したと考えられており、その存在は少数の真菌種に限られています。このドメインの出現は、特定の環境ニッチに適応するための真菌の進化において重要なステップを示している可能性があります。
– 種限定的な分布: Wor3ドメインを持つタンパク質は、カンジダ・アルビカンスなどの一部の真菌種にのみ存在します。この限定的な分布は、Wor3ドメインが特定の生物学的プロセスや環境適応に特化していることを示唆しています。
– 白色-不透明遷移の調節: カンジダ・アルビカンスにおいて、Wor3タンパク質(およびそのドメイン)は、菌の形態的な遷移を調節することにより、病原性や生殖戦略に影響を与える重要な役割を果たします。白色-不透明遷移は、菌体の形態、病原性、宿主との相互作用において変化をもたらすため、Wor3の調節機能は特に重要です。
● 研究の展望
Wor3ドメインの研究は、真菌の病原性や適応戦略の理解を深める上で有望な分野です。このドメインの詳細な構造と機能の解明は、真菌病の新たな治療標的の同定や、真菌の進化と適応メカニズムの理解に貢献する可能性があります。また、進化の過程で最近出現したDNA結合ドメインの研究は、遺伝子調節ネットワークの進化や新規性の出現に関する一般的な原理を解明する上でも重要です。
OB-foldドメイン
OBフォールド(Oligonucleotide/oligosaccharide-binding fold)ドメインは、オリゴヌクレオチドやオリゴ糖に結合するために特化した小さな構造モチーフです。このドメインは、70から150アミノ酸の範囲で構成され、一本鎖のDNAやRNAと結合する能力を持つため、一本鎖結合タンパク質に分類されます。
● OBフォールドの構造
OBフォールドは、主にβシートによって形成された構造で、一本鎖のDNAやRNA、オリゴ糖などとの相互作用に特化しています。このモチーフの構造的特徴は、核酸や糖分子との結合面を提供し、高度な特異性と結合強度を実現します。OBフォールドドメイン内の特定のアミノ酸残基は、核酸や糖分子との水素結合や静電相互作用を介して結合します。
● OBフォールドの生物学的役割
OBフォールド蛋白質は、生命現象における核心的なプロセスに広範囲にわたって関与しています:
– DNA複製: OBフォールドを持つタンパク質は、DNA複製過程においてプライマーとして機能する一本鎖DNAに結合することで、DNAポリメラーゼの活動を支援します。
– DNA修復と組換え: 一本鎖DNAの切れ端に結合することで、DNA修復や組換え過程における適切な配列の認識と整列を促進します。
– 転写と翻訳: 一本鎖RNAに結合することで、mRNAの安定性の維持や、翻訳の調節に関与します。
– コールドショック応答: 低温環境における生存戦略として、コールドショック応答において重要な役割を果たします。
– テロメア維持: テロメア領域に特異的に結合し、染色体末端の保護やテロメアの長さの調節に関与します。
● まとめ
OBフォールドドメインは、その小さなサイズにもかかわらず、生命現象における多様なプロセスにおいて中心的な役割を果たす、極めて重要な構造モチーフです。DNAやRNA、オリゴ糖などの生体分子との高い特異性と結合強度を持つことで、細胞の遺伝情報の保持、伝達、実行に不可欠な機能を提供します。OBフォールドの詳細な研究は、これらの生命維持機能の理解を深めるだけでなく、疾患治療やバイオテクノロジーの応用においても貴重な洞察を提供する可能性があります。






