目次
この記事では、免疫系の重要な構成要素である細胞傷害性T細胞(CTL)について包括的に解説します。CTLは、がん細胞やウイルスに感染した細胞を特定して破壊する役割を担っており、免疫療法やがん治療における応用が注目されています。この記事を通じて、CTLの基本的な特性、機能、がん治療への応用に至るまで、最新の研究成果を含めて紹介します。
第1章 細胞傷害性T細胞(CTL)の概要
CTLの基本的な特性
● CTLの定義と基本機能
CTL(Cytotoxic T Lymphocytes)は、細胞障害性T細胞とも呼ばれ、獲得免疫応答において重要な役割を果たすリンパ球の一種です。CTLは、特定の抗原を認識し、感染細胞やがん細胞などの異常細胞を直接攻撃して殺傷する能力を持っています[13]。CTLは、主にウイルス感染細胞や腫瘍細胞を標的とし、細胞表面に提示された特異的な抗原を認識することで活性化されます。活性化されたCTLは、標的細胞に対して細胞死を誘導する分子を放出し、標的細胞を破壊します。このプロセスは、体内の異常細胞を排除し、感染の拡大を防ぐために不可欠です。
CTLは、T細胞受容体(TCR)を介して特異的な抗原を認識します。TCRは、主要組織適合遺伝子複合体(MHC)クラスI分子に結合されたペプチド抗原を認識することができます。CTLは、CD8コア受容体を持ち、これがMHCクラスI分子と相互作用することで、CTLの抗原特異性を高めます[10]。
● CTLの成熟と活性化のプロセス
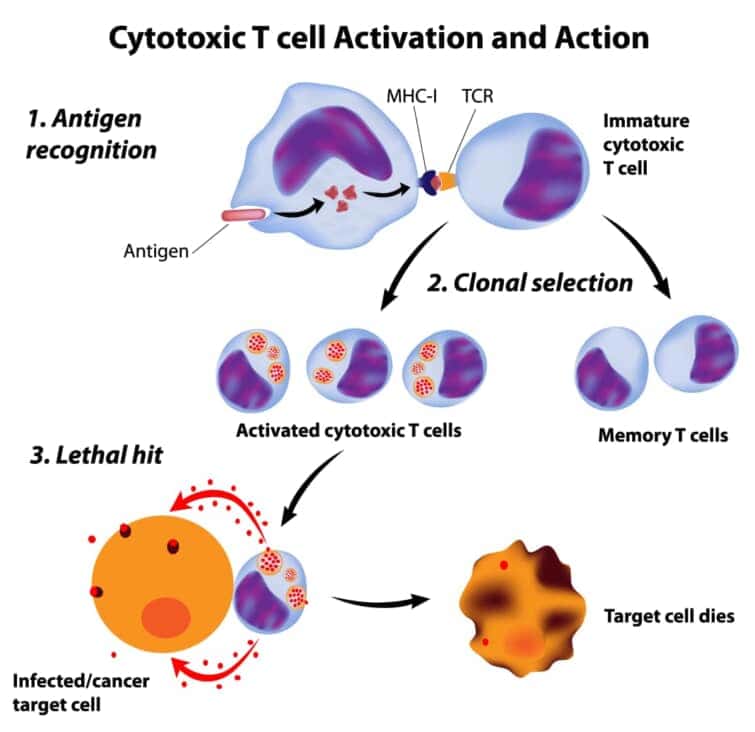
CTLの成熟と活性化のプロセスは、未成熟なT細胞が樹状細胞(DC)によって提示される抗原を認識することから始まります。未成熟なT細胞は、骨髄で生成され、胸腺で成熟し、ナイーブT細胞として末梢リンパ組織に移動します。ナイーブT細胞が特異的な抗原を提示する成熟したDCに遭遇すると、活性化されて増殖し、エフェクターT細胞に分化します[10]。
成熟したDCは、抗原提示の際に共刺激分子B7.1やB7.2を発現し、これらがT細胞のCD28と相互作用することで、T細胞の完全な活性化を促進します。活性化されたCTLは、標的細胞に対して細胞死を誘導する分子、例えばペルフォリンやグランザイムを放出し、標的細胞のアポトーシスを誘発します[10]。
CTLは、がん細胞と正常細胞を区別する能力は持っていませんが、MHCクラスI分子に結合した特異的な抗原を認識することで、ごく限られた一部の標的細胞のみを攻撃します[13]。CTL療法は、このCTLの機能を利用してがん治療に応用されることがあります。CTL療法では、患者自身のCTLを体外で増殖させ、再び患者に戻すことでがん細胞を攻撃することを目的としています[13]。
- 参考文献・出典
-
[1] marblerule.com/labview_mazukore19/
[2] docs.oracle.com/cd/E16338_01/server.112/b56303/ldr_concepts.htm
[3] patents.google.com/patent/JP2001509490A/ja
[4] docs.oracle.com/cd/E82638_01/sutil/oracle-sql-loader-control-file-contents.html
[5] www.thermofisher.com/jp/ja/home/life-science/cell-analysis/cell-analysis-learning-center/immunology-at-work/dendritic-cell-overview.html
[6] www.bio-rad.com/webroot/web/pdf/lsr/japan/japanese/literature/Z11587L_FlowCytometry_Basic_Guide.pdf
[7] cosmos01.jp/%E5%BD%93%E9%99%A2%E3%81%AE%E3%80%8C%E5%85%8D%E7%96%AB%E7%B4%B0%E8%83%9E%E7%99%82%E6%B3%95%E3%80%8D
[8] access.redhat.com/documentation/ja-jp/red_hat_enterprise_linux/7/html/security_guide/sec-defining_audit_rules_and_controls
[9] clta.jp/clt/
[10] www.med.kurume-u.ac.jp/med/immun/20171026-2.pdf
[11] www.thermofisher.com/jp/ja/home/life-science/cell-analysis/cell-analysis-learning-center/immunology-at-work/natural-killer-cell-overview.html
[12] products.sint.co.jp/siob/blog/what-is-sql-loader
[13] www.lymphocyte-bank.co.jp/ctl.html
[14] www.u-rd.com/products/CTL-24CL_36CL_60CL_100CL.html
[15] patents.google.com/patent/JP2021045176A/ja
[16] pionet.co.jp/sqlloader%E5%85%A5%E9%96%80/
[17] www.kurims.kyoto-u.ac.jp/~cs/lecture2009/lecture09ModelChecking.pdf
[18] www.magicsoftware.co.jp/files/magic_help/V9Plus/DocumentKey/CTLx93xc1x90xab.htm
[19] www.u-rd.com/products/CTL-12L-10_tab3.html
[20] jp.misumi-ec.com/vona2/detail/221000835359/
CTLの生物学的役割
細胞傷害性T細胞(CTL)は、適応免疫系の重要な構成要素であり、主にウイルスや細菌などの細胞内病原体や腫瘍に対する免疫防御に重要な役割を果たします[5]。CTLは、CD8+T細胞とも呼ばれ、感染を除去するために体をスキャンする細胞傷害性エフェクター細胞への増殖と分化により病原体に応答する能力を持っています[5]。
● CTLによる免疫応答メカニズム
CTLは、特定の抗原を認識し、その抗原を提示する細胞を特異的に攻撃・排除する能力を持っています。この過程は、主に以下のステップで構成されます[5][6][7]:
1. 抗原提示: CTLの活性化には、抗原提示細胞(APC)による抗原の提示が必要です。APCは、病原体や腫瘍細胞からの抗原を取り込み、MHCクラスI分子に結合させて細胞表面に提示します。CTLは、TCR(T細胞受容体)を介してこのMHCクラスI分子に結合した抗原を認識します[6][7]。
2. 活性化と増殖: 抗原を認識したCTLは、コストィミュラトリー分子の相互作用とサイトカインの影響により活性化されます。活性化されたCTLは増殖し、エフェクターCTLとなります[6][7]。
3. 標的細胞の攻撃: エフェクターCTLは、抗原を提示する標的細胞に接近し、細胞接着分子によって結合します。その後、CTLはパーフォリンやグランザイムなどの細胞傷害分子を標的細胞に放出し、細胞死を誘導します[6][7]。
4. メモリーCTLの形成: CTLの一部は、メモリーCTLとして生存し、同一抗原の再侵入時に迅速な免疫応答を可能にします[6]。
● CTLのターゲットとなる細胞の特定方法
CTLのターゲットとなる細胞は、特定の抗原をMHCクラスI分子に結合させて細胞表面に提示している細胞です。この抗原は、ウイルスや細菌などの病原体由来のものや、変異した自己タンパク質など、腫瘍細胞特有のものが含まれます[5][6][7]。
ターゲット細胞の特定方法には、以下のような技術が用いられます:
– フローサイトメトリー: 特定の抗原を提示する細胞を標識し、フローサイトメトリーによってその細胞群を特定する方法です[2]。
– ELISPOTアッセイ: CTLが放出するサイトカイン(例えばIFN-γ)を検出し、抗原特異的なCTLの活性を測定する方法です。このアッセイは、CTLが特定の抗原に反応しているかどうかを評価するのに有用です[10]。
これらの方法により、CTLが攻撃するターゲット細胞を特定し、CTLの免疫応答メカニズムを理解することが可能になります。
- 参考文献・出典
-
[1] www.jst.go.jp/crest/immunesystem/result/04.html
[2] www.bio-rad.com/webroot/web/pdf/lsr/japan/japanese/literature/Z11587L_FlowCytometry_Basic_Guide.pdf
[3] www.chem-agilent.com/page_data/1006839/Agilent_Uncover_New_Drug_Targets_Through_Cell_Metabolism_J_rev00_202202B.pdf
[4] www.yodosha.co.jp/jikkenigaku/articles/index.html?ci=23000
[5] www.thermofisher.com/jp/ja/home/life-science/cell-analysis/cell-analysis-learning-center/immunology-at-work/cytotoxic-t-cell-overview.html
[6] www.hemapedia.jp/hemapedia/basic-immunity-course/season1-lesson03
[7] ruo.mbl.co.jp/bio/product/allergy-Immunology/article/Cellular-immunity-Humoral-immunity.html
[8] immunotherapy-uth.jp/tumor_immunity/index04/
[9] citd.juntendo.ac.jp/project/
[10] www.mstechno.co.jp/categories/view/85
[11] ruo.mbl.co.jp/bio/product/allergy-Immunology/article/Natural-immunity-Acquid-immunity.html
[12] www.jove.com/it/t/56255/in-vivo-assay-for-detection-antigen-specific-t-cell-cytolytic?language=Japanese
[13] libir.josai.ac.jp/il/user_contents/02/G0000284repository/pdf/JOS-PhDK39.pdf
[14] app.jove.com/t/2724?language=Japanese
[15] www.microbio.med.saga-u.ac.jp/Lecture/kohashi3/part1/ctl.html
第2章 CTLの活性化と機能
CTLの活性化過程
細胞傷害性T細胞(CTL)の活性化は、複数の段階を経て行われます。この過程は、抗原提示、T細胞受容体(TCR)の役割、コストimulation、およびサイトカインによる活性化を含みます。
● 抗原提示とT細胞受容体(TCR)の役割
CTLの活性化は、まず抗原提示細胞(APC)による抗原の提示から始まります。APCは、樹状細胞やマクロファージなどが含まれ、体内に侵入した病原体からの抗原を処理し、そのペプチド断片を主要組織適合複合体(MHC)クラスI分子に結合させて細胞表面に提示します[1][4][6][7][12][13]。CTLは、その表面に存在するT細胞受容体(TCR)を介して、APCが提示するMHCクラスI分子と結合した抗原ペプチドを認識します[1][2][6][7][12][13]。TCRは、抗原特異的な認識を行い、CTLの活性化の初期段階で重要な役割を果たします。
● コストimulationとサイトカインによる活性化
CTLの完全な活性化には、TCRのシグナルに加えて、コストimulatoryシグナルが必要です。このコストimulationは、APC上のCD80やCD86と、T細胞上のCD28との相互作用によって提供されます[13]。コストimulatoryシグナルがない場合、T細胞はアナジー(機能不全状態)に陥ることがあります。
さらに、CTLの活性化と増殖には、サイトカインが重要な役割を果たします。例えば、インターロイキン-2(IL-2)は、CTLの増殖と生存を促進する重要なサイトカインです[13][14]。他にも、インターロイキン-12(IL-12)は、CTLの分化と機能を促進することが知られています[13]。
CTLの活性化は、抗原の認識とコストimulationの両方が揃った状態で、サイトカインによる追加のシグナルを受けることで、最終的に効果的な細胞傷害応答を引き起こすことができます。CTLは、活性化されると、感染細胞や腫瘍細胞を標的として攻撃し、細胞死を誘導することができます[12][14]。
このように、CTLの活性化過程は、抗原提示、TCRの認識、コストimulation、およびサイトカインによるシグナル伝達の複雑な相互作用によって成り立っています。これらの過程を通じて、CTLは病原体や腫瘍細胞に対する免疫応答を効果的に行うことができます。
- 参考文献・出典
-
[1] www.jst.go.jp/crest/immunesystem/result/03.html
[2] oncolo.jp/dictionary/tcr
[3] patents.google.com/patent/JP2019050831A/ja
[4] www.pharm.okayama-u.ac.jp/lab/bunsei/research/dc/
[5] www.jst.go.jp/crest/immunesystem/result/02.html
[6] www.thermofisher.com/us/en/home/life-science/cell-analysis/signaling-pathways/t-cell-receptor-tcr/t-cell-receptor-tcr-overview.html
[7] immu.ganno-clinic.jp/immunotherapy/antigen-and-receptor/
[8] www.jbpo.or.jp/med/jb_square/autoimmune/immunology/im03/01.php
[9] www.jst.go.jp/crds/pdf/2020/FR/CRDS-FY2020-FR-04/CRDS-FY2020-FR-04_20300.pdf
[10] www.cira.kyoto-u.ac.jp/j/research/finding/180525-100000.html
[11] www.jstage.jst.go.jp/article/kagakutoseibutsu1962/37/3/37_3_177/_pdf/-char/ja
[12] www.thermofisher.com/jp/ja/home/life-science/cell-analysis/cell-analysis-learning-center/immunology-at-work/cytotoxic-t-cell-overview.html
[13] www.hemapedia.jp/hemapedia/basic-immunity-course/season1-lesson03
[14] ruo.mbl.co.jp/bio/product/allergy-Immunology/article/Cellular-immunity-Humoral-immunity.html
[15] kaken.nii.ac.jp/grant/KAKENHI-PROJECT-16K16638/
[16] www.linguee.jp/%E8%8B%B1%E8%AA%9E-%E6%97%A5%E6%9C%AC%E8%AA%9E/%E7%BF%BB%E8%A8%B3/multiple%2Bcytokines.html
[17] nrid.nii.ac.jp/en/nrid/1000080284488/
[18] www.jstage.jst.go.jp/article/jsci/28/1/28_1_21/_pdf
[19] www.cancer-clinic.jp/remedy/immunotherapy/dak/
[20] www.ncc.go.jp/jp/information/pr_release/2021/1115/press_release_20211115.pdf
CTLの細胞傷害機能
細胞傷害性T細胞(CTL)は、免疫系の重要な構成要素であり、特に獲得免疫において中心的な役割を果たします。CTLは、感染細胞やがん細胞などの異常細胞を特異的に認識し、細胞死を誘導することで体を守ります。
● 細胞死を誘導するメカニズム
CTLは、標的細胞表面のMHCクラスI分子に提示される抗原ペプチドを認識します。この認識は、CTLの細胞表面にあるT細胞受容体(TCR)を介して行われます。CTLが標的細胞と結合すると、細胞傷害性顆粒を放出し、標的細胞にアポトーシスを誘導します[2][3][5][6][7]。
● グランザイムとパーフォリンの役割
CTLが放出する細胞傷害性顆粒には、主にグランザイムとパーフォリンが含まれています。これらの分子は、標的細胞の細胞膜に孔を形成し、細胞内に侵入してアポトーシスを引き起こす役割を担います。
– パーフォリン: パーフォリンは、標的細胞の細胞膜に多量体を形成し、孔を作ります。これにより、細胞膜の透過性が変化し、グランザイムが細胞内に侵入するための通路が作られます[2][3][5][6][13].
– グランザイム: グランザイムは、セリンプロテアーゼの一種で、孔を通じて標的細胞内に侵入します。細胞内に入ったグランザイムは、カスパーゼを活性化することでアポトーシスのカスケードを引き起こし、最終的に細胞死に至らせます[2][3][5][6][13].
CTLによる細胞傷害機能は、体内での感染防御やがん細胞の排除において極めて重要です。CTLは、感染細胞やがん細胞を効率的に排除することで、健康な細胞を保護し、病気の進行を防ぐ役割を果たしています。
- 参考文献・出典
-
[1] www.e-kanpo.jp/saibousi/saibousi.php
[2] www.jstage.jst.go.jp/article/kagakutoseibutsu1962/37/3/37_3_177/_pdf/-char/ja
[3] www.yodosha.co.jp/jikkenigaku/keyword/3807.html
[4] m-hub.jp/biology/4434/321
[5] www.thermofisher.com/jp/ja/home/life-science/cell-analysis/cell-analysis-learning-center/immunology-at-work/cytotoxic-t-cell-overview.html
[6] ruo.mbl.co.jp/bio/product/allergy-Immunology/article/mhc-Tcell.html
[7] www.hemapedia.jp/hemapedia/basic-immunity-course/season1-lesson03
[8] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2018.900690/data/index.html
[9] www.cellsignal.jp/science-resources/cell-death-overview
[10] institute.yakult.co.jp/dictionary/word_7.php
[11] bsd.neuroinf.jp/wiki/%E7%B4%B0%E8%83%9E%E6%AD%BB
[12] research.kobayashi.co.jp/glossary/nk.html
[13] www.cellsignal.jp/science-resources/t-cell-signaling-phenotyping
[14] www10.showa-u.ac.jp/~biolchem/H20-P2cell-11.pdf
[15] cytix.co.jp/business/nk/
[16] blog.cellsignal.jp/mechanisms-of-cell-death-apoptosis
[17] www.microbio.med.saga-u.ac.jp/Lecture/kohashi3/part1/ctl.html
[18] research.kobayashi.co.jp/glossary/ctl.html
[19] www.jstage.jst.go.jp/article/kagakutoseibutsu1962/37/9/37_9_576/_pdf/-char/ja
[20] ja.wikipedia.org/wiki/%E7%B4%B0%E8%83%9E%E5%82%B7%E5%AE%B3%E6%80%A7T%E7%B4%B0%E8%83%9E
第3章 CTLとがん治療
CTLを活用したがん免疫療法
● CTLを活用したがん免疫療法
●# 概要
細胞傷害性Tリンパ球(CTL)を活用したがん免疫療法は、がん細胞を特異的に認識して攻撃するCTLの能力に着目した治療法です。CTLは、がん細胞の表面に存在する特定の抗原を認識し、その細胞を破壊する免疫細胞です。CTLベースの治療戦略は、がん細胞に対する免疫応答を強化し、がんの退縮や転移・再発の抑制を目指します[1][2][3][4][5][6][7][8][9][10][11][12][13][14][15][16][17][18][19][20]。
● 治療戦略
CTLベースの治療戦略には、以下のようなアプローチがあります。
1. 養子免疫療法(Adoptive Immunotherapy):
この方法では、がん患者から採取したCD8+ T細胞を体外で腫瘍特異的なCTLに分化誘導し、活性化させた後、再び患者に移入します。しかし、免疫抑制状態にあるがん患者からは、治療に十分な数の腫瘍特異的CTLを誘導することが困難であるため、キメラ抗原受容体(CAR)を発現させたCTLを創製するアプローチが開発されています[1]。
2. キメラ抗原受容体(CAR)T細胞療法:
CAR T細胞療法は、患者のT細胞に遺伝子工学を用いてCARを導入し、これによってがん細胞を特異的に認識し攻撃する能力を付与します。CARは、T細胞受容体(TCR)と異なり、MHCの発現に依存せずにがん細胞を認識できるため、MHCの発現が低下しているがん細胞に対しても効果的です[1]。
3. がんワクチン:
がんワクチンは、がん抗原を含むワクチンを患者に投与し、体内でCTL応答を誘導することを目的としています。がん抗原は、がん細胞の表面に存在する特定のペプチドやタンパク質で、これを標的とするCTLを活性化させることで、がん細胞を攻撃します[13][14]。
● CTL応答の誘導
CTL応答を誘導するためには、以下のステップが必要です。
1. がん抗原の同定:
がん細胞特異的な抗原やネオアンチゲンを同定し、これを標的とするCTLを活性化させます[13]。
2. 抗原提示細胞(APC)の活用:
抗原提示細胞、特に樹状細胞は、がん抗原を取り込み、リンパ節へ運び、T細胞に提示します。これにより、抗原特異的なCTLが選択的に活性化されます[13]。
3. CTLの活性化と増殖:
活性化されたCTLはリンパ節を出て、腫瘍局所に到達し、がん細胞を攻撃します。この過程で、CTLは腫瘍微小環境の影響を受け、その効果が調節されます[13][14]。
4. 免疫チェックポイント阻害剤の併用:
CTLA-4やPD-1などの免疫チェックポイント阻害剤を併用することで、CTLの活性化をさらに促進し、がん細胞に対する攻撃力を高めることができます[16]。
CTLベースのがん免疫療法は、がん治療の新たな可能性を開くものであり、多くの臨床試験や研究が進行中です。しかし、まだ多くの課題があり、実用化に向けた研究開発が続けられています[14][19][20]。
- 参考文献・出典
-
[1] www.jstage.jst.go.jp/article/dds/28/1/28_35/_pdf
[2] www.lymphotec.co.jp/ryouhou/
[3] saiseiiryo.jp/faq/detail/post_8.html
[4] www.amed.go.jp/content/000062056.pdf
[5] immunotherapy-uth.jp/tumor_immunity/index06/
[6] www.fukuoka-meneki.com/immuno/
[7] cosmos01.jp/%E3%81%8C%E3%82%93%E3%81%A8%E5%85%8D%E7%96%AB
[8] www.kantei.go.jp/jp/singi/kenkouiryou/siryou/pdf/r04_modality_tyosahoukoku.pdf
[9] gan911.com/6immunotherapy/
[10] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-10044300/
[11] oici.jp/file/202208/akazawa-doc01.pdf
[12] patents.google.com/patent/JP2001509490A/ja
[13] immunotherapy-uth.jp/tumor_immunity/index04/
[14] cell-medicine.com/about/immunotherapy_4.html
[15] jglobal.jst.go.jp/detail?JGLOBAL_ID=201902269625625236
[16] bibgraph.hpcr.jp/abst/pubmed/20384858?click_by=rel_abst
[17] mhlw-grants.niph.go.jp/project/2176
[18] www.wam.go.jp/gyoseiShiryou-files/documents/2010/10510/20100709_1shiryou2-1_4.pdf
[19] www.j-immunother.com/dr/ordermaid/ctl.html
[20] www.eisai.co.jp/ir/library/presentations/pdf/4523_180918.pdf
CTLとCAR-T細胞療法
● CAR-T細胞療法の原理
CAR-T細胞療法は、患者自身のT細胞を採取し、これにキメラ抗原受容体(CAR)を導入することで、特定のがん細胞を認識し攻撃する能力を持たせたT細胞を体外で増やし、再び患者に戻す治療法です。このCARは、がん細胞表面に発現する特定の抗原に対して高い特異性を持ち、T細胞の活性化と攻撃力を高める機能を兼ね備えています。この治療法は、特にB細胞性の白血病やリンパ腫に対して効果が示されています[1][2][3][4][5][6][7][8][9][10][11][12][13][14][15][16][17][18][19][20]。
● CTLとCAR-T療法の相違点
CTL(細胞傷害性T細胞)は、体内で自然に発生する免疫細胞の一種で、ウイルス感染細胞やがん細胞など、異常を持つ細胞を認識し攻撃する能力を持っています。CTLは、T細胞受容体(TCR)を介して、主要組織適合遺伝子複合体(MHC)クラスI分子に提示される抗原ペプチドを認識します。しかし、がん細胞は免疫回避機構を持っており、CTLの攻撃から逃れることがあります[1][2][3][4][5][6][7][8][9][10][11][12][13][14][15][16][17][18][19][20]。
一方、CAR-T細胞療法では、T細胞に対して遺伝子工学的にCARを導入することで、がん細胞特異的な抗原を直接認識し攻撃する能力を持たせます。この方法では、MHCの提示を必要とせず、がん細胞が免疫回避機構を用いてもCAR-T細胞による攻撃から逃れることが難しくなります。また、CAR-T細胞は、がん細胞に対して非常に高い特異性と攻撃力を持つため、特定のがんタイプに対して高い治療効果を発揮することが期待されています[1][2][3][4][5][6][7][8][9][10][11][12][13][14][15][16][17][18][19][20]。
● CTLとCAR-T療法の連携
CTLとCAR-T細胞療法の連携については、両者ががん治療において異なるメカニズムで作用することから、相補的な治療戦略としての可能性が考えられます。例えば、CAR-T細胞療法が特定のがん細胞に対して高い効果を発揮する一方で、CTLは体内で自然に発生し、がん細胞だけでなく、ウイルス感染細胞など幅広い異常細胞に対して攻撃を行うことができます。したがって、CAR-T細胞療法を中心とした治療に加えて、CTLの活性化を促進することで、がん治療の効果をさらに高めることが期待されます。また、がん細胞がCAR-T細胞に対する抵抗性を獲得した場合に、CTLが補助的な役割を果たす可能性もあります[1][2][3][4][5][6][7][8][9][10][11][12][13][14][15][16][17][18][19][20]。
- 参考文献・出典
-
[1] www.jstage.jst.go.jp/article/dds/28/1/28_35/_pdf
[2] www.daiichisankyo.co.jp/files/news/ir/pdf/005396/%E3%82%BB%E3%83%9F%E3%83%8A%E3%83%BC%E8%B3%87%E6%96%99.pdf
[3] www.jstage.jst.go.jp/article/naika/108/7/108_1384/_pdf
[4] www.novartis.com/jp-ja/research-development/car-t
[5] www.novartis.com/jp-ja/research-development/technology-platforms/cell-therapy/car-t-cell-therapy-and-beyond/car-t-cell-therapy-pioneering-cancer-therapy
[6] www.jstage.jst.go.jp/article/jjtc/65/6/65_851/_pdf
[7] www.kymriah.jp/hcp/moa/car_t.html
[8] www.nhk.or.jp/kenko/atc_1432.html
[9] sihds14.secand.net/img/abstract_20220606.pdf
[10] reprocell.co.jp/archive/car-t/
[11] www.juntendo.ac.jp/news/17687.html
[12] chuo.kcho.jp/department/hematology_kymriah/
[13] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2018.900495/data/index.html
[14] medical.nikkeibp.co.jp/leaf/all/cancernavi/report/202310/581228.html
[15] cell-medicine.com/topics/car-t%E7%99%82%E6%B3%95%E3%82%82%E3%81%8C%E3%82%93%E7%B4%B0%E8%83%9E%E6%95%B0%E3%81%AE%E5%B0%91%E3%81%AA%E3%81%95%E3%81%8C%E3%82%AD%E3%83%A2%E3%81%A0%E3%81%A3%E3%81%9F/
[16] s-igaku.umin.jp/DATA/61_04/61_04_02.pdf
[17] www.juntendo.ac.jp/news/16776.html
[18] anjokosei.jp/mame/mame-35/
[19] kawamoto.frontier.kyoto-u.ac.jp/common/images/diary%20data/2019/191021BioJapan2019ACTMSKawamoto.pdf
[20] publish.m-review.co.jp/files/tachiyomi_J0104_0302_0020-0022.pdf
第4章 CTLの研究と臨床応用の現状
CTL研究の最新動向
● 最新の研究成果
CTL(細胞傷害性T細胞)に関する最新の研究動向は、がん、感染症、自己免疫疾患などの分野での応用に焦点を当てています。以下は、最近の研究成果の概要です。
1. がん治療におけるCTL療法:
– 子宮頸がんに対する持続可能なiPSC由来CTL療法の臨床研究が進行中であり、iPS細胞由来のCTLが免疫細胞の攻撃を回避し、子宮頸がんに対する抗腫瘍効果を保持することが示されています[1][12]。
– CMV特異的CTLを用いた治療が、造血幹細胞移植後のCMV感染に対して有効であることが示されており、CMV-CTL療法がCMV血症患者において高いCR率を示しています[4]。
2. 感染症におけるCTLの役割:
– コロナウイルス感染症におけるCTLの重要性が強調されており、CTLやインターフェロン-γがウイルス排除において重要な役割を果たしていることがマウスモデルで示されています[2]。
3. 自己免疫疾患におけるCTLの関与:
– 再生障碍性貧血(AA)の発病機序において、CTLが自己免疫によるHSPCの損傷に関与していることが示されています[3]。
● 研究における課題と展望
CTL研究における課題としては、以下の点が挙げられます。
– CTL療法の安全性と効果の最適化:
CTL療法は有望ながん治療法として注目されていますが、患者ごとのCTLの特異性や、治療に伴う副作用の管理が課題です。また、CTL療法の効果を最大化するための最適な条件を見つけることが重要です。
– CTL応答の調節機構の解明:
CTL応答を調節する分子機構の解明は、CTL療法の効果を向上させるために不可欠です。特に、CTLの活性化や記憶応答の制御に関する研究が必要です。
– CTL療法の応用範囲の拡大:
CTL療法はがん治療において有効ですが、感染症や自己免疫疾患など他の疾患に対する応用可能性も探求されています。これらの疾患におけるCTLの役割をより深く理解することが、治療法の開発につながります。
展望としては、CTL療法の精度を高めるための新たな技術や、CTL応答を調節する新しい分子標的の同定が期待されています。また、CTL療法と他の免疫療法との組み合わせによるシナジー効果の研究も進められています。これらの研究は、がんや感染症、自己免疫疾患の治療において、より効果的で安全な治療法の開発に寄与することが期待されています。
- 参考文献・出典
-
[1] www.amed.go.jp/content/000105444.pdf
[2] www.a.u-tokyo.ac.jp/topics/topics_20200818-1.html
[3] www.ncbi.nlm.nih.gov/pmc/articles/PMC7342439/
[4] www.ncbi.nlm.nih.gov/pmc/articles/PMC8607013/
[5] www.ncbi.nlm.nih.gov/pmc/articles/PMC10397063/
[6] www.most.gov.cn/gnwkjdt/202111/t20211102_177735.html
[7] www.jst.go.jp/crest/immunesystem/result/04.html
[8] www.ncbi.nlm.nih.gov/pmc/articles/PMC10475430/
[9] www.tmd.ac.jp/grad/rheu/research/iim.html
[10] most.gov.cn/gnwkjdt/202205/t20220507_180591.html
[11] www.ncc.go.jp/jp/information/pr_release/2021/1115/index.html
[12] www.juntendo.ac.jp/news/16776.html
[13] www.niid.go.jp/niid/images/plan/procure/kouhyou/r03kikan.pdf
[14] www.ncbi.nlm.nih.gov/pmc/articles/PMC7342528/
[15] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2018.900495/data/index.html
[16] www.jst.go.jp/crest/immunesystem/result/07.html
[17] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-10044300/
[18] www.bilibili.com/read/mobile?id=27618447
[19] www.healthtreejapan.com/about-5
[20] sohu.com/a/713700216_121124375/?pvid=000115_3w_a
CTL応用の臨床例と成果
細胞傷害性Tリンパ球(CTL)を用いた治療は、がん治療の分野で特に注目されています。CTLは、がん細胞や感染細胞を特異的に認識し、殺傷する能力を持つ免疫細胞です。この治療法は、がん細胞に対する特異的な攻撃を可能にし、健康な細胞への影響を最小限に抑えることが期待されています。以下に、CTLを用いた治療の臨床試験結果、成功事例、および今後の課題について紹介します。
● 成功事例
– 悪性黒色腫に対するCTL療法: 悪性黒色腫患者に対するCTL療法の臨床試験では、腫瘍縮小効果が認められました。この研究では、CTLに腫瘍血管標的化能および腫瘍血管傷害活性を付与することにより、治療効果の改善が示されました[2]。
– 子宮頸がん治療におけるiPS細胞由来CTL療法: 順天堂大学の研究では、iPS細胞由来のCTLを用いた子宮頸がん治療の基礎的データが得られ、新規治療法としての可能性が示されました。この研究では、iPS細胞をゲノム編集することで、同種免疫反応を軽減したCTLの作製に成功し、子宮頸がんを強力に抑制できることが発見されました[5]。
● 今後の課題
– CTLの臨床応用における課題: CTL療法の臨床応用には、いくつかの課題が存在します。例えば、免疫系が抑制されている癌患者からは治療に十分な数のCTLを分化誘導することが困難であったり、患者に再移入したCTLの腫瘍組織集積性が乏しかったりすることが挙げられます[2][3]。また、CTLの大量調製や特異的なCTLを効率的に増やす方法に関する研究が必要です[11]。
– 複合がん免疫療法の開発: 単剤でのCTL療法の効果は限定的であるため、化学療法や免疫チェックポイント阻害剤といった他の治療法との併用による複合がん免疫療法の開発が進められています。最適な複合がん免疫療法を行うためには、免疫のメカニズムと抗腫瘍免疫応答に対する理解の深化が重要です[9]。
CTLを用いた治療は、がん治療において大きな可能性を秘めていますが、その臨床応用にはまだ解決すべき課題が多く存在します。今後、これらの課題を克服し、より効果的ながん治療法の開発につながることが期待されています。
- 参考文献・出典
-
[1] office.icu.ac.jp/ctl/upload/docs/revised_20190129_vol23no1_all_except_New%20Teaching%20Staff_ja_bookmarked.pdf
[2] www.jstage.jst.go.jp/article/dds/28/1/28_35/_pdf
[3] www.jstage.jst.go.jp/article/dds/32/3/32_184/_pdf
[4] www.kansai-u.ac.jp/ctl/activity/pdf/kiyo_no.6_pdf/kiyo_no.6_04.pdf
[5] www.juntendo.ac.jp/news/16776.html
[6] immunotherapy-uth.jp/news/pdf/pdf29_2.pdf
[7] medical.nikkeibp.co.jp/leaf/all/cancernavi/report/202310/581228.html
[8] www.justsystems.com/jp/lab/efficiency/efficiency-idea.html
[9] immunotherapy-uth.jp/tumor_immunity/index09/
[10] www.cancer-clinic.jp/remedy/immunotherapy/dak/
[11] cell-medicine.com/about/immunotherapy_4.html
[12] www.jstage.jst.go.jp/article/jsci1978/18/6/18_6_621/_pdf
[13] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-02454397/
[14] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-21K02655/
[15] mhlw-grants.niph.go.jp/project/16205
[16] ctl.nju.edu.cn/_upload/article/files/22/68/a6256b184b5fa825bb50b95ec56c/c0a7a7da-6a87-4086-b4c9-adcacf54034a.pdf
[17] repository.kulib.kyoto-u.ac.jp/dspace/bitstream/2433/203855/1/ngh058001_107.pdf
[18] kaken.nii.ac.jp/ja/file/KAKENHI-PROJECT-24659657/24659657seika.pdf
[19] mhlw-grants.niph.go.jp/project/13629
[20] www.amed.go.jp/program/houkoku_h28/0103012.html
第5章 CTLの未来と課題
CTL療法の将来性
細胞傷害性T細胞(CTL)療法は、がん治療における免疫療法の一つであり、がん細胞を特異的に攻撃するCTLを利用する治療法です。CTLは、がん細胞やウイルス感染細胞など、体にとって異物となる細胞を認識し、破壊する能力を持つT細胞の一種です[6][10]。この治療法は、がん細胞のみを標的とすることができるため、正常細胞への影響が少なく、副作用が低減される可能性があります。
CTL療法の将来性については、いくつかの点で期待が寄せられています。まず、CTL療法は、がん細胞に対する特異的な攻撃能力を持つため、がん治療の精度を高めることができると考えられています。特に、正常細胞になく、がん細胞だけに存在するがん抗原を標的とすることで、がん細胞のみを選択的に破壊することが可能になります[12]。
また、CTL療法は、がんの再発予防や進行抑制、さらには患者の生活の質(QOL)の改善にも効果が期待されています。患者自身のリンパ球を使用するため、副作用が極めて少なく、ほぼ全てのがんに適応できる可能性があります[11]。
さらに、CTL療法の開発においては、がん細胞の他にがん抗原を用いた方法も考案されており、臨床応用が進んでいます[13]。これにより、CTL療法の適用範囲が広がり、より多くのがん患者に利益をもたらす可能性があります。
最近の研究では、iPS細胞由来のCTLを用いた治療法の開発も進められており、これにより同種免疫反応を軽減でき、T細胞の機能も強化されることが期待されています[16]。このような次世代のCTL療法の開発は、CTL療法の効果をさらに高め、がん治療における新たな選択肢となる可能性を示しています。
以上の点から、CTL療法はがん治療における免疫療法の一つとして、その将来性が非常に高いと考えられます。がん細胞を特異的に攻撃する能力、副作用の低減、さらには次世代のCTL療法の開発による治療効果の向上など、多くの利点が期待されています。これらの進展により、CTL療法はがん治療における重要な役割を果たす可能性があります。
- 参考文献・出典
-
[1] www.jstage.jst.go.jp/article/dds/28/1/28_35/_pdf
[2] www.lymphotec.co.jp/ryouhou/
[3] wellbeinglink.com/treatment-map/cancer/immunotherapy/
[4] www.jstage.jst.go.jp/article/naika/108/3/108_430/_pdf
[5] cosmos01.jp/%E3%81%8C%E3%82%93%E5%85%8D%E7%96%AB%E7%99%82%E6%B3%95%E3%81%AE%E5%88%86%E9%A1%9E
[6] www.midtown-amc.jp/words/tctl.html
[7] cosmos01.jp/%E3%81%8C%E3%82%93%E3%81%A8%E5%85%8D%E7%96%AB
[8] immunotherapy-uth.jp/news/pdf/pdf29_2.pdf
[9] www.cancer-clinic.jp/remedy/immunotherapy/dak/
[10] www.thermofisher.com/jp/ja/home/life-science/cell-analysis/cell-analysis-learning-center/immunology-at-work/cytotoxic-t-cell-overview.html
[11] www.lymphotec.co.jp/lymphocyte-therapy/
[12] cell-medicine.com/about/immunotherapy_4.html
[13] www.lymphotec.co.jp/ryouhou/henreki/
[14] www.bioaccell.com/for-clinic/natural_killer_therapy
[15] wellbeinglink.com/treatment-map/stage4immunotherapy/ctltherapy/
[16] www.qlifepro.com/news/20231215/hpv-ctl.html
[17] www.j-immunother.com/dr/ordermaid/ctl.html
[18] www.youtube.com/watch?v=RFdHkptsSbo
[19] www.bioaccell.com/natural_killer_therapy/akt-dc
[20] prtimes.jp/main/html/rd/p/000000595.000021495.html
CTL療法の課題と解決策
CTL療法は、がん治療における免疫細胞療法の一つであり、細胞傷害性Tリンパ球(CTL)を用いてがん細胞を特定し、攻撃する方法です。この治療法は、特に獲得免疫を用いる免疫細胞療法の中で最強のものとされていますが、いくつかの課題が存在し、それらの解決策に向けた研究が進められています。
● CTL療法の課題
1. 標的細胞の特定: CTLはがん細胞と正常細胞を区別する能力がなく、限られた一部の標的細胞しか攻撃しません。個々のCTLは特定の認識番号に基づいて標的細胞を攻撃するため、がん細胞を効果的に認識し攻撃するためには、標的となるがん細胞を正確に特定する必要があります[16]。
2. 体外でのCTLの誘導培養の難しさ: CTLの誘導培養は作業が煩雑であり、成功率も高くないため、実用的ではありません。臨床応用には、効率的なCTLの誘導培養方法の開発が必要です[20]。
3. 免疫逃避: がん細胞は、免疫系から逃れるために、MHC分子の発現を低下させるなどの機構を持っています。これにより、CTLががん細胞を認識しにくくなり、治療効果が低下する可能性があります[20]。
● 解決策と次世代免疫療法への展望
1. 標的細胞の特定の改善: CTLが特定のがん細胞をより効果的に認識できるように、がん特異的な抗原を標的とするCAR-T細胞療法などが開発されています。これにより、がん細胞のみを選択的に攻撃することが可能になります[17]。
2. 効率的なCTL誘導培養の開発: CTLの誘導培養を効率化するための研究が進められています。例えば、iPS細胞技術を用いてCTLを大量に作製する方法が研究されており、これにより、CTL療法の実用化が期待されています[12]。
3. 免疫逃避の克服: がん細胞の免疫逃避機構を克服するための研究が進められています。例えば、がん細胞がMHC分子の発現を低下させる機構を解明し、それを阻害する方法を開発することで、CTL療法の効果を向上させることが可能になるかもしれません。
次世代免疃療法への展望としては、これらの課題を克服し、より効果的で安全ながん治療法の開発が期待されています。特に、がん細胞の特異的な標的を見つけ出し、それを攻撃する免疫細胞を効率的に誘導・増殖させる技術の進歩が、がん治療の新たな可能性を開くことになるでしょう。
- 参考文献・出典
-
[1] www.jstage.jst.go.jp/article/dds/28/1/28_35/_pdf
[2] www.jstage.jst.go.jp/article/jcam/1/1/1_1_85/_pdf
[3] www.lymphotec.co.jp/ryouhou/
[4] www.cancerplus.jp/cancer/
[5] www.jstage.jst.go.jp/article/faruawpsj/56/6/56_529/_pdf/-char/ja
[6] wellbeinglink.com/treatment-map/stage4immunotherapy/ctltherapy/
[7] wellbeinglink.com/treatment-map/cancer/immunotherapy/
[8] www.amed.go.jp/news/release_20211206-02.html
[9] www.takeda.com/jp/our-impact/our-stories/accelerating-next-generation-cell-therapies/
[10] www.noile-immune.com/dcms_media/other/Dr_Tamada_Lecture_04_Noile_Immune_Biotech.pdf
[11] bio-med.jp/projects/kobayashi/
[12] www.juntendo.ac.jp/news/16776.html
[13] www.jstage.jst.go.jp/article/jjiao/37/2/37_29/_pdf/-char/ja
[14] cytix.co.jp/news/dctc-fusioncell-is-activating-ctl-with-multiple-antigens-including-neo-antigens/
[15] www.cancer-clinic.jp/remedy/immunotherapy/dak/
[16] www.lymphocyte-bank.co.jp/ctl.html
[17] www.shinshu-u.ac.jp/faculty/medicine/chair/i-shoni/clinical-study/cart-t.html
[18] www.yamaguchi-u.ac.jp/news/14597/index.html
[19] www.cellsignal.jp/learn-and-support/videos-and-webinars/deciphering-car-t-cells
[20] cell-medicine.com/about/immunotherapy_4.html






