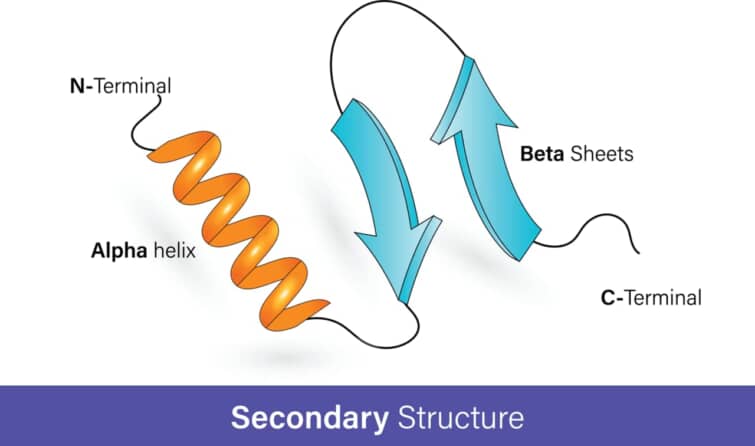
タンパク質はアミノ酸がペプチド結合(-NH-X-CO-NH-X-CO-NH-、ペプチド鎖)で連なっているが、ペプチド鎖中のH(水素)とO(酸素)は水素結合で引き合う性質があり、これがタンパク質の形を決める大きな要因となっている。
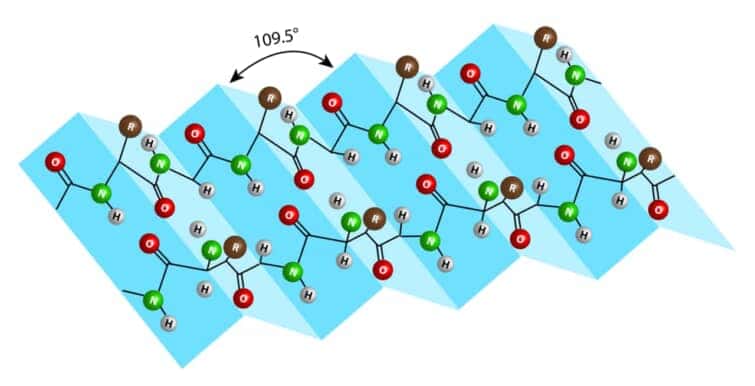
ペプチド鎖が伸びた状態でつながり、これらが数本平行または逆平行に重なった際に、あるペプチド鎖のC=O基のOと隣のストランドのN-H基のHが水素結合して出来たプリーツシート(ひだ状の板)構造をβシート(構造)とよぶ。
βシートは、βストランドから形成される二次構造のうち、より広いタイプのものである。ストランドは、タンパク質の骨格が通常4~10残基の範囲で「ジグザグ」に動いている。単一のβストランドはエネルギー的に好ましくない。しかし、2つの異なるβストランド上の残基間の水素結合のパターンによって特徴づけられるβシートを形成することができる。第1鎖の残基iは、第2鎖の残基jと水素結合を形成する。1本目のi+2が2本目のj+2に結合する場合(平行βシート)と、1本目のi+2が2本目のj-2に結合する場合(反平行βシート)である。ヘリックスの場合とは異なり、βシートでは水素結合残基の配列が離れている場合がある。ほとんどのβシートは2本以上のストランドから形成されている。一般的に、βストランドと-シートはEの文字で略される。









