エンドサイトーシス経路と分泌経路では、異なる運命にあるカーゴタンパク質が小胞に集められ、小胞輸送を通じて特定の標的部位に運ばれます。このプロセスにおいて、AP(アダプタータンパク質)複合体は重要な役割を果たしています。AP複合体は、カーゴタンパク質の細胞質尾部にあるソーティングシグナルに結合し、クラスリンや他のアクセサリータンパク質をリクルートして、カーゴを小胞輸送体に濃縮し、ドナー膜から標的オルガネラの膜へと輸送します。
現在までに、AP-1、AP-2、AP-3、AP-4、AP-5という5つのAP複合体が同定されています。これらはそれぞれ2つの大型サブユニット(γ/α/δ/ε/ζ と β1-5)、1つの中型サブユニット(μ1-5)、および1つの小型サブユニット(σ1-5)で構成されています。これらのサブユニットのいくつかは異なるアイソフォームを持っており、例えばAP-1には2つのγ(γ1とγ2)、2つのμ(μ1Aとμ1B)、3つのσアイソフォーム(σ1A、σ1B、σ1C)があります。AP-2には2つのαアイソフォーム(αAとαC)、AP-3には2つのβ(β3Aとβ3B)、2つのμ(μ3Aとμ3B)、2つのσアイソフォーム(σ3Aとσ3B)があります。
異なるサブユニットアイソフォームの組み合わせにより、多様なAPヘテロ4量体が生じ、組織特異的な発現と機能を示す可能性があります。特に、AP-1とAP-3は研究されています。μ1Aまたはμ1Bを含むAP-1複合体は、AP-1AまたはAP-1Bと呼ばれ、AP-1Aはユビキタスに、AP-1Bは上皮特異的に発現しています。また、AP-3複合体には、ユビキタスなAP-3A(δ、β3A、μ3A、σ3)と神経細胞特異的なAP-3B(δ、β3B、μ3B、σ3)の両方のアイソフォームが存在します。
過去10年間で、AP複合体を介したタンパク質輸送に関する理解は急速に進展しました。特にAP複合体の局在、シグナル認識、構造、および機能に関する最近の研究が注目されています。AP複合体の異なる変異体の正確な分子的・生理学的特性は、一部の変異体については詳細に研究されていますが、他の変異体についてはまだ未解明の部分が多くあります。
これらの複合体は、細胞内のタンパク質輸送と細胞の機能の維持に不可欠な役割を果たしており、その詳細な研究は細胞生物学において重要な意義を持ちます。
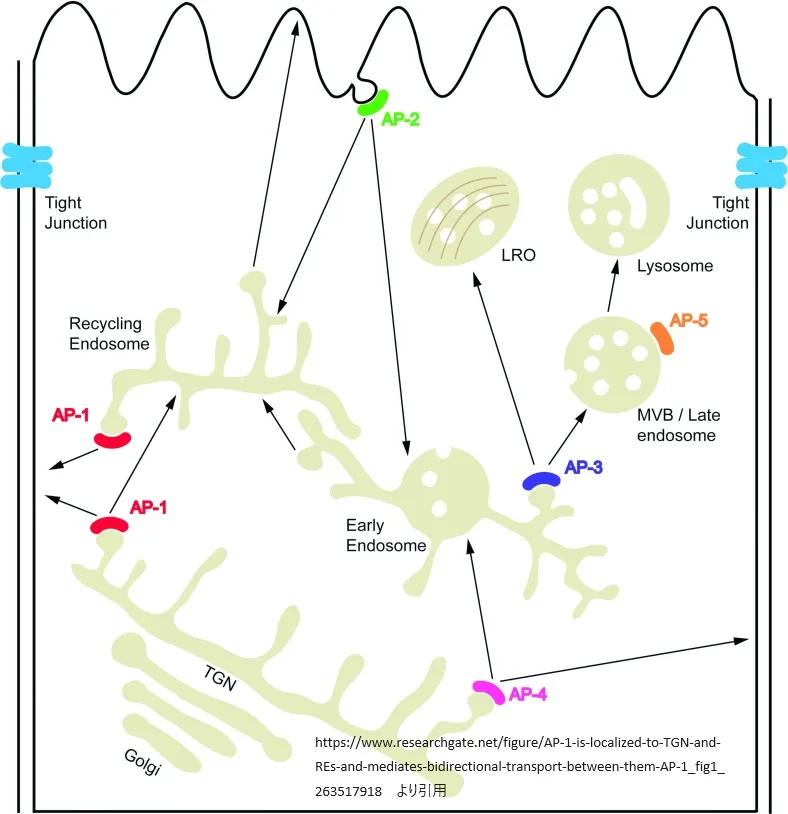
APタンパク質の細胞内局在
膜貫通タンパク質の輸送は、タンパク質ネットワークによってコントロールされ、効率的でダイナミックなプロセスです。最近の10年間で、AP複合体がこのプロセスの重要な調整因子として認識されるようになりました。各AP複合体は、細胞内の特定の小器官の機能に関与しています。
AP-1は、TGN(transgolgi network;トランスゴルジ網)とエンドソームに存在し、クラスリンコート小胞にも結合します。AP-1Aは、Arf1やPI4Pと直接結合することにより、TGNとエンドソームに局在します。AP-1AとAP-1Bは、TGNマーカーやREマーカーと共に存在し、基底膜側のカーゴと共に移動します。AP-1AとAP-1Bの膜リクルートメントは、Arf-GEF阻害剤BFAに反応します。
AP-2は、細胞膜に存在し、クラスリンを介して、受容体や接着分子、ウイルスタンパク質などのエンドサイトーシスを促進します。AP-2の細胞膜への選択的な動員は、αサブユニットとμ2サブユニットがPIP2と結合することで起こります。また、Arf6がAP-2の膜へのリクルートに影響を与える可能性があります。
AP-3とAP-4も、TGNやエンドソーム膜に存在し、Arf1によって制御されます。AP-3は、チューブ状エンドソームから後期エンドソームへの輸送を担い、神経細胞特異的なAP-3Bは、細胞外小器官の形成と放出に重要です。AP-4は、TGNからエンドソームへの輸送を担い、上皮細胞や神経細胞の極性選別に関与します。
AP-5は後期エンドソームに存在し、SPG11やSPG15と相互作用します。AP-5の膜リクルート機構はまだ不明ですが、BFAに対して感受性がないため、ARF1によって制御されていない可能性があります。
AP複合体が認識するシグナル
AP複合体は、膜貫通カーゴタンパク質の特異的なソーティングシグナルを認識し、それによって膜輸送に特異性を与えます。AP複合体が認識する選別シグナルは、カーゴタンパク質の細胞質ドメインに存在し、アミノ酸の短い直鎖状配列から構成されます。最も一般的な選別シグナルは、チロシンベースの(YXXØ)シグナルと、ジロイシンベースの([DE]XXXL[LI])シグナルです。ここで、Xは任意のアミノ酸、Øは大きくて疎水性のアミノ酸(例えばロイシン、イソロイシン、メチオニン、バリン、フェニルアラニン)を意味します。これらのシグナルは、AP-1、AP-2、AP-3によって認識されます。
チロシンベースの(YXXØ)シグナルは、AP複合体と結合しますが、ジロイシンベースのシグナルは、γ-σ1、α-σ2、δ-σ3のサブユニットと結合します。これらの一般的なシグナルに加えて、AP複合体が認識する非正規のシグナルも存在します。例えば、TfR(トランスフェリン受容体)の基底側ソーティングシグナル(GDNS)がμ1Bサブユニットとの相互作用に寄与していることが示されています。また、非正規のシグナルのサブセットは、μ1Bによって特異的に認識されます。
AP-4が認識するシグナルは、以前は明確に定義されていませんでしたが、アルツハイマー病のAPP(アミロイド前駆体タンパク質)との相互作用が発見され、YKFFE配列とAP-4 μ4サブユニットとの間の特異的で強固な相互作用が報告されました。このYKFFE配列は、YXXØシグナルの最小コンセンサスに適合していますが、その結合の特性はYXXØシグナルと異なります。
AP-4 μ4サブユニットは、他の非共有タイプのシグナルも認識します。例えば、フェニルアラニンベースのモチーフ(FGSV)、FRモチーフ、そしてジ芳香族残基(FXF)などが、μ4との結合に必要です。これらのシグナルは、特定のカーゴタンパク質との相互作用を可能にし、膜輸送の特異性を高めます。
一方で、AP-5が認識する選別シグナルは、現在のところ特定されていません。YXXØシグナルに結合するための保存された残基がμ5サブユニットには存在しないため、AP-5は他のAP複合体とは異なる方法でカーゴタンパク質と結合する可能性があります。
これらの様々なシグナルの認識と結合メカニズムにより、AP複合体は細胞内のカーゴタンパク質の正確なソーティングと輸送を制御し、細胞の機能と生理を維持します。各AP複合体が独自のシグナル認識パターンを持つことで、細胞内輸送の複雑さと多様性が高まります。
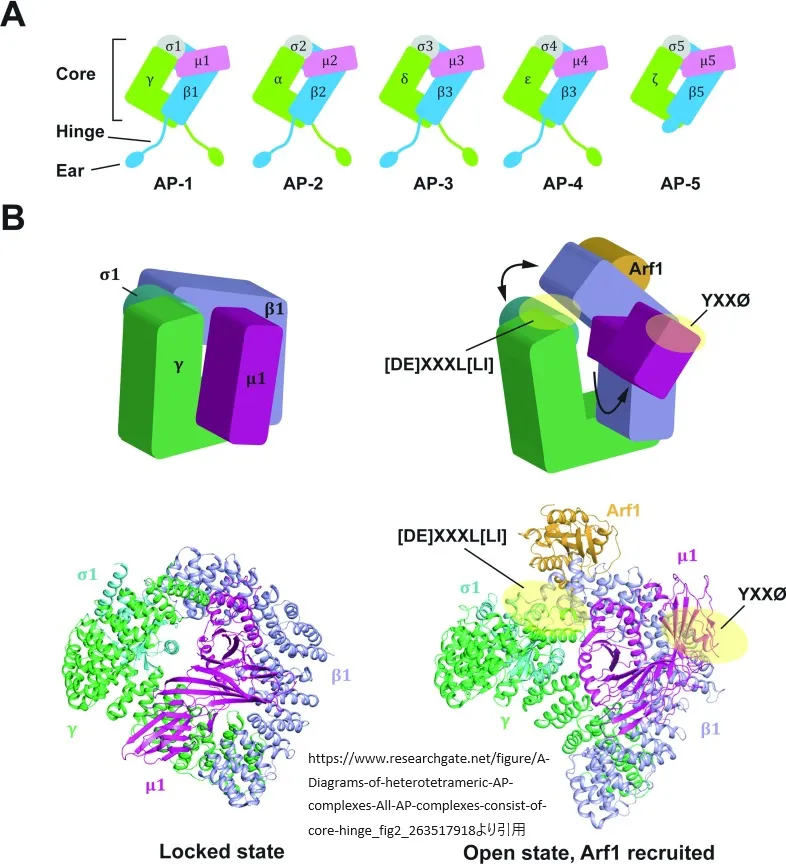
www.researchgate.net/figure/A-Diagrams-of-heterotetrameric-AP-complexes-All-AP-complexes-consist-of-core-hinge_fig2_263517918
より引用
(A)ヘテロ4量体AP複合体の図。すべてのAP複合体はコア、ヒンジ、イヤードメインから成るが、ヒンジドメインを持たないAP5はヒンジドメインを持たない。コアドメインはカーゴタンパク質の結合と膜局在を担う。ヒンジとイヤードメインは、コートタンパク質や制御/アクセサリータンパク質との相互作用に重要である。(B)AP-1コア複合体のロック構造とAP-1コア複合体のオープン構造。ロック状態では、AP-1のカーゴ結合部位は2つの大きなサブユニット(γとβ1)。Arf1が結合すると、AP-1は大きな構造変化を起こし、開いた状態になる。開いた状態ではオープン状態では、 [D/E]XXXL[L/I]とYXXØの両方の結合部位が露出し、対応するカーゴタンパク質と結合する準備ができている(黄色い丸)。構造はPDBコード1W63(ロック状態)[53]と4HMY(オープン状態) [15]から作成した。
AP複合体と結合するカーゴの構造
AP複合体の結合に関して、カーゴの構造的側面を理解するためには、AP複合体のコアドメインと付属ドメインの構造を考慮する必要があります。AP複合体のコアドメインは、2つの大きなサブユニットのN末端基幹ドメインと、全長のμサブユニットとσサブユニットによって構成されます。このコアドメインは、YXXØや[DE]XXXL[LI]のような異なるソーティングシグナルを認識する重要な役割を果たします。このシグナルの認識は、AP複合体の膜リクルートメントにも影響を与えます。
大きなサブユニットのC末端ドメインには、調節/アクセサリータンパク質と相互作用する「付属」(「耳」とも呼ばれる)ドメインが存在します。これらの付属ドメインは、構造化されていない「ヒンジ」ドメインによってコアドメインと連結されています。AP-1、AP-2、AP-3のヒンジドメインにはクラスリン結合モチーフがあり、これがクラスリン被覆小胞の形成に寄与します。
μサブユニットは、YXXØモチーフの認識に特に重要です。このモチーフの結合部位の構造は、μ2サブユニットの構造によって最初に明らかにされました。特に、上皮成長因子受容体(EGFR)のシグナルペプチドとμ2サブユニットとの複合体の構造が解析され、この構造は細長いバナナ型をしており、17枚のβシートから構成されています。EGFRとTGN38からの選別シグナルは、μ2サブユニットのサブドメインAの2本の平行なβシート鎖(β1とβ16)の表面に結合します。これにより、チロシンとØ残基がβ16の両側にある疎水性ポケットに結合し、チロシン残基の水酸基はμ2のAsp176と相互作用します。この結合機構はμ1とμ3にも保存されており、YXXØモチーフへの結合に重要です。
AP-3複合体のμ3サブユニットも、TGN38のソーティングシグナルペプチドと結合する際に、μ2-TGN38と類似した結合界面を持っています。一方、AP-4複合体のμ4サブユニットは、非正規のYX[FYL][FL]Eモチーフを持つアミロイド前駆体タンパク質(APP)のソーティングシグナルと異なるメカニズムで結合します。μ4とAPPソーティングシグナルペプチドの結合界面はμ2のシグナル結合部位とは異なり、β4、β5、およびβ6のサブドメインAに位置しています。
AP-5のμ5サブユニットに関しては、その構造や結合メカニズムはまだ解明されていません。
さらに、[DE]XXXL[LI]モチーフは、AP-1、AP-2、AP-3のγ-σ1、α-σ2、δ-σ3サブユニットに結合します。例えば、AP-2複合体では、このモチーフのジロイシン部分がσ2サブユニットの疎水性ポケットに結合し、αとσ2の塩基性パッチにも結合します。
AP複合体とカーゴタンパク質の結合には、APコアドメインが「ロック」型から「オープン」型に大きくコンフォメーション変化することが必要です。AP-2複合体の場合、この構造変化はPIP2結合によって膜にリクルートされた際に起こり、YXXØと[DE]XXXL[LI]のシグナルが対応する結合部位にアクセスできるようになります。
一方、AP-1複合体の場合、ホスホイノシチド結合だけでは膜への動員には不十分であり、Arf1がAP-1のロック型からオープン型への構造変化を促進します。
これらの詳細な構造的解析は、AP複合体がどのようにして特異的なカーゴタンパク質と結合し、それを特定の細胞内部位に輸送するかを理解する上で非常に重要です。
APタンパクの役割
AP複合体は、細胞内タンパク質輸送の重要な調節因子として機能し、その機能不全は膜貫通タンパク質の正しい局在化を阻害し、シグナル伝達、オルガネラの動態、組織の恒常性を含む多様な細胞プロセスに影響を及ぼします。これらの役割は、遺伝性疾患やノックアウトマウスモデルを通じて明確に示されています。
例えば、マウスにおけるγ1サブユニットとμ1Aサブユニットのノックアウトは胚致死であり、AP-1の胚発生における重要な役割を示しています。σ1B欠損マウスは生存可能であるものの、海馬シナプスにおけるシナプス小胞の再利用障害、運動協調性の低下、長期空間記憶の障害を示しています。μ1Bノックアウトマウスは、上皮特異的なμ1Bサブユニットの欠損により腸上皮細胞の極性の崩壊と過形成、自然発症の慢性大腸炎を引き起こします。
人間では、σ1Aサブユニットの変異がMEDNIK症候群を引き起こし、σ1Bサブユニットの変異がFried症候群やPettigrew症候群を引き起こすなど、AP複合体の異常が様々な神経皮膚症候群を引き起こすことが知られています。σ1Cの変異は、膿疱性乾癬という重篤な自己炎症性皮膚疾患を引き起こします。また、クローン病患者ではμ1Bの発現低下が見られ、腸腫瘍と関連していることが示されています。
AP-2複合体のノックアウトはマウスでは胚致死であり、σ2のミスセンス変異はFHH3(家族性低カルシウム尿症高カルシウム血症3型)を引き起こすことが知られています。これは、カルシウム感受性受容体のエンドサイトーシスの低下によるものです。
β3A変異を持つパールマウスでは毛色と眼の色の希釈、異常なリソソーム関連小器官(LRO)が見られ、これはHPS-2(Hermansky-Pudlak症候群2型)と関連しています。一方で、神経細胞特異的なAP3B変異マウスは、神経学的な欠陥のみを示し、色彩的な欠陥は示さないことが知られています。
AP-4β4ノックアウトマウスでは、軽度の運動ニューロン障害が見られる一方で、ヒトのAP-4の4つのサブユニットの変異は、遺伝性痙性対麻痺(HSP)を引き起こします。これはAP-4の神経細胞における重要な機能を示唆しています。
AP-5のノックアウトマウスはまだ確立されていませんが、ヒトのAP-5変異はHSP病を引き起こすことが示されており、AP-4とAP-5は同じカーゴタンパク質を選別するか、または軸索の維持に重要である可能性があることを示唆しています。これらの発見は、AP複合体が細胞内のさまざまな組織や機能において重要な役割を果たしていることを示しています。特に、神経系や皮膚などの特定の組織でのその役割は、遺伝性の疾患や実験モデルを通じて詳細に研究されています。これらの結果は、AP複合体の異なるサブユニットが特定の生理的プロセスや病理状態において独自の重要な機能を持つことを明らかにしています。
参考文献:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4114066/