目次
AAAタンパク質ファミリーとは?
生物はATP(アデノシン三リン酸)をはじめとするNTP(ヌクレオチド三リン酸)のエネルギーを利用しいる。一般にNTPase(ヌクレオチドがアデノシンならばATPase)とよばれる酵素は、NTPの加水分解で得られる化学エネルギーを運動エネルギーなどに変換する役割を担っている。
ATPaseは、分子の中心を貫く棒状の回転軸タンパク質の回転が回転することで、 生命のエネルギー通貨といえるATPを合成したり、細胞内部のpH調整を行ったり、細胞内の酸性小胞の酸性化などを担う回転分子モータータンパク質である。
ATP加水分解という化学エネルギーが回転という運動エネルギーに変換されるメカニズムはいまだに解決していない。
AAA ATPase(様々な細胞活動に関連するATP)は、タンパク質分解、タンパク質フォールディング、膜輸送、細胞骨格制御、オルガネラの生合成、DNA複製、細胞内運動など、多くの細胞活動において重要な役割を果たしている。最近の構造学的および酵素学的研究により、この大きなタンパク質スーパーファミリーを定義する保存されたAAAドメインの特性についての手がかりが得られつつある。多くの場合、AAAドメインはヘキサミックリングに集合し、ATPaseサイクルの間にその形状が変化すると考えられる。このヌクレオチドに依存した構造変化は、結合したタンパク質に張力を与え、それによってAAAタンパク質がポリペプチドを展開したり、タンパク質間の相互作用を解消したり、軌道に沿って一方向性の運動を起こしたりすることを可能にするかもしれない。このように、AAAタンパク質は、様々な生物学的環境において、基本的に類似した構造変化を利用する独自の方法を進化させてきた、幅広いクラスのメカノザイムであると考えられる。
AAAタンパク質の機能
多くの複雑な細胞現象は、アデノシン三リン酸の加水分解から得られるエネルギーを効率的に機械的な力の生成に結びつけるために、分子機械と呼ばれる多タンパク質複合体に依存している。これらの複合体は、NTPを燃料として熱力学的な障壁を乗り越えて燃焼させるという、エンジンに似た動作をする。この類似性から、これらのタンパク質複合体は「分子機械」と呼ばれている。分子機械の多様なセットは、DNA複製や組換え、制御されたタンパク質分解、タンパク質の分解、タンパク質複合体の分解など、無数の細胞機能に必要である。
AAA+ ATPaseスーパーファミリー(ATPases Associated with various cellular activities)のメンバーは、多くの分子機械の重要な構成要素である。AAA+タンパク質は、隣接する2つのサブユニットの活性部位を正確に配置する保存されたモジュールによって定義され、ATP加水分解を触媒する。多くの場合、AAA+タンパク質はリング構造を形成し、中央チャネルに突出する特殊なループを用いて高分子基質を中央チャネルに移動させる。
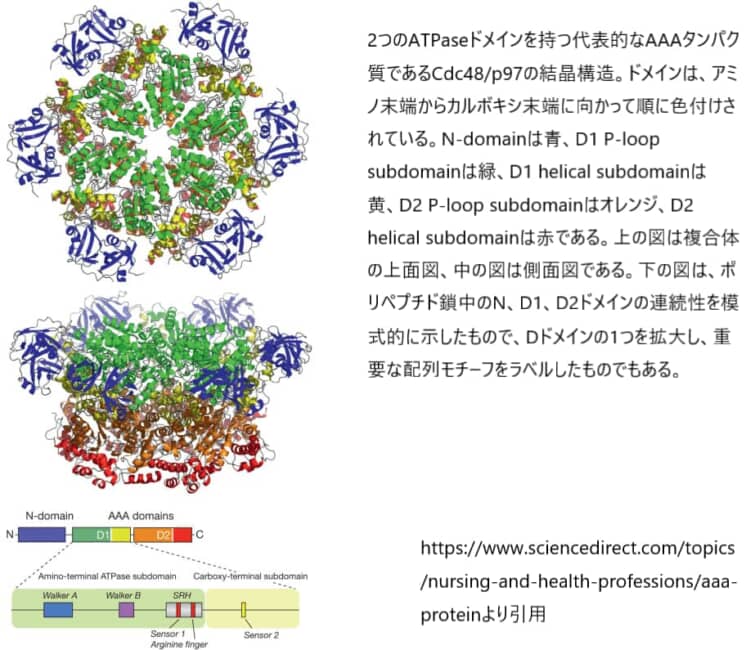
AAAタンパク質サブユニットの構造とヌクレオチドの結合および加水分解の様式
AAAタンパク質は通常、中央にやや狭い孔を持つ6量体のオリゴマーを形成する(図1上段)。すべてのファミリーメンバーに共通しているのは、ATPase活性を持つ1つまたは2つのAAAドメイン(D1およびD2と命名)が存在することである。
AAAドメインには、ヌクレオチドを結合して加水分解するN末端側のα/βドメイン(ロスマンフォールド)とC末端側のα-ヘリカルドメインの2つのサブドメインがある。 N末端ドメインは200-250アミノ酸の長さで、Walker AとWalker Bのモチーフを含み、AAAファミリーを含むスーパーファミリーの他のPループNTPaseと共通している。 ほとんどのAAAタンパク質は、オリゴマー化、基質結合、および/または制御に使用される追加のドメインを持っていて、これらのドメインは、AAAモジュールのN-末端またはC-末端に存在する。
アミノ末端の非ATPaseドメイン(N-domain)は、基質の結合と認識に関与している。様々なファミリーメンバーの機能が異なるのは、N-domainが多種多様であることが大きな要因である。それぞれのタンパク質に応じて、組み立てを仲介するサブユニット間の接触は、Nドメイン、AAAドメインのいずれか、または両方に存在する。
AAA+タンパク質のフォールドを定義する二次および三次構造の特徴
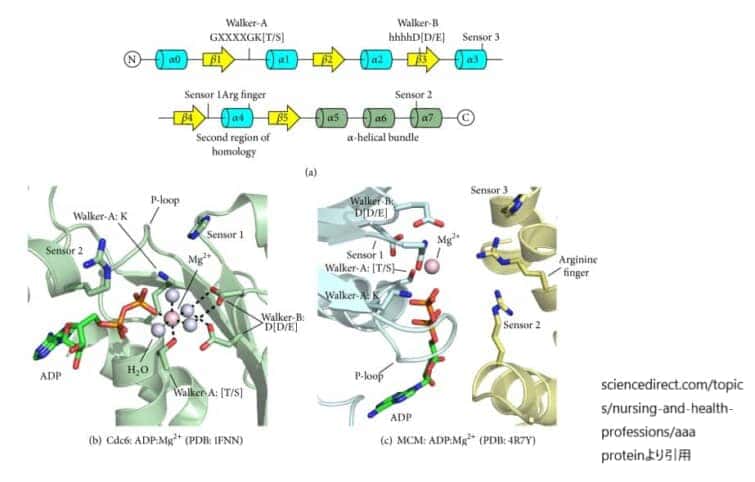
AAA+ ATPaseドメインの特徴。
(a) AAA+のα-β-αフォールドのトポロジーと活性部位の特徴位置を一次配列と二次構造で示す。コアα/βフォールド内のヘリックスとストランドはそれぞれ青と黄色で着色している。C末端のリッドドメインのヘリックスは薄緑色で着色されている。
(b) 活性部位の残基は、ヌクレオチドとMg2+を結合するために正確に配置されている。Mg2+カチオンは、Walker-Aスレオニン、結合したヌクレオチドのβ-リン酸、4つの水分子によって直接配位される。破線は議論された分子間相互作用を示す。結合したADP分子と活性部位の重要な特徴を棒で、水分子を水色の球で、マグネシウムイオンをマゼンタの球で示している。
(c)ATPaseサイトは、隣接するサブユニットの残基によってサブユニットの界面に形成される。サイトの左側にはWalker-A、Walker-B、Sensor 1の3つの残基が同じサブユニットに存在し(青色、「シス作用」)、サイトの右側には3つの基本残基が隣のサブユニットから存在する(黄色、「トランス作用」)。結合したADPとMg2+は(b)と同じように表現されている。
AAA+ファミリーは、より大きなP-loopタンパク質スーパーファミリーのサブセットである。すべてのP-loopファミリーメンバーは構造的に類似しており、明確なα/βフォールドを有している。AAA+ドメインは200-250個のアミノ酸からなり,中央のβシートはβ5-β1-β4-β3-β2の順に並んでいる(図(a))。βシートの両側にはα-ヘリックスがあり、3層のα-β-αサンドイッチを形成している。AAA+ファミリーのメンバーを他のPループNTPaseと区別する特徴として、β1とβ3の間にβ4が挿入されていること、β5に隣接する反平行β鎖がないこと、β5またはβ2に直接隣接する追加の鎖がないことが挙げられる。
AAA+ドメインの一次配列モチーフ
1. ウォーカーAモチーフとウォーカーBモチーフ
すべてのPループNTPaseと同様に、AAA+タンパク質はATPの結合と加水分解に重要なWalker-AとWalker-Bモチーフ残基を持っている。
Walker-Aモチーフ
Walker-Aモチーフは、GXXXXGK[T/S]配列で構成されており、Xは任意のアミノ酸で、C末端の残基はスレオニンまたはセリンである。構造的には,AAA+トポロジーの中でβ1とα1の間にループを形成している。この特徴は、典型的なP-ループであり、AAA+タンパク質で最も強く保存されている配列の一つである。マイナーな逸脱としては,NtrC(GXXXXGK[D/E]),MCM(GXXXXGAKS),MoxR(GXXXXAK[T/S])などがある。
ウォーカーBモチーフ
ウォーカーBモチーフは、β3にまたがっており,hhhhD[D/E]という配列で特徴づけられる。hは任意の疎水性残基を表し,C末端の残基はアスパラギン酸またはグルタミン酸である。AAA+タンパク質が触媒するATP加水分解は、β3のC末端のWalker-Bグルタミン酸残基に依存している。この保存されたグルタミン酸残基は、ATP加水分解の際に、γ-リン酸への求核攻撃のために水分子を活性化する触媒塩基である。
相同性のある第2の領域
すべてのAAA+タンパク質には、Walker-BモチーフのC-terminalに「第二相同領域(Second Region of Homology: SRH)」と呼ばれる領域が存在する。この領域は,β4の一部,α4ヘリックス全体,α4とβ5をつなぐループを含む15-20残基に及ぶ(図(a))。SRHには,ATPの加水分解に必要なセンサー1とアルギニンフィンガーモチーフが含まれている。これらの特徴は、ヌクレオチドの加水分解を調整し、AAA+タンパク質複合体のサブユニット間でヌクレオチドの加水分解に伴う構造変化を伝播させる。その機能的重要性と、他のウォーカー型NTPaseにはSRHが存在しないことから、この領域はAAA+ファミリーの特徴を示すものとなっている。
Sensor 1
センサー1モチーフは、SRHのN末端にあるβ4とα4をつなぐループに位置する(図(a))。センサー1は極性のある残基で、最も一般的なのはアスパラギンだが、セリン、スレオニン、アスパラギン酸の場合もある。構造的には、ウォーカーAモチーフとウォーカーBモチーフの間に位置し、ウォーカーBのグルタミン酸と協働して、結合したATP分子のγ-リン酸に攻撃を加える求核性水分子を正しく配向させる機能を持つ。このように、センサー1はATPアーゼの機能だけでなく、ATPの加水分解に関連するあらゆる機能に不可欠である。例えば、ATP依存性プロテアーゼであるFtsHでは、センサー1のアスパラギンを変異させると、このモチーフがタンパク質分解を行うドメインに位置していないにもかかわらず、プロテアーゼ活性が失われる。
AAA+ ATPaseサイトは、タンパク質複合体の隣接するサブユニットの界面にある(図(c))。ATPaseサイトのWalker-A/BとSensor 1残基はすべて同じサブユニット上にあり、アルギニンフィンガーは隣のサブユニットに由来する。このため、Walker-A/BとSensor 1残基は “cis-acting “残基、アルギニンフィンガーは “trans-acting “残基と定義されている。一次配列では、アルギニンフィンガーはSRHのC末端付近にあり、α4とβ5の間のループに位置している。この残基はほぼ常にアルギニンであるが、時折リジン残基が存在することもある。アルギニンフィンガーという名称はRas-RasGAP複合体のようなGTPase活性化タンパク質と構造が類似していることに由来する。Ras-RasGAP複合体の結晶構造では、アルギニン残基が「フィンガーループ」を介してGTP結合部位に向かっていることが観察される。また,既知のAAA+オリゴマーの構造では同様のアルギニン残基が隣接するサブユニットのATP結合・加水分解部位に向かっていることが分かっている。GTPase活性化タンパク質に基づいて、アルギニンフィンガーは結合したヌクレオチドのγ-リン酸と分子間相互作用を形成し、加水分解時の遷移状態で発生する蓄積された負電荷を安定化させると考えられる。FtsHやNtrCの変異研究では、アルギニンフィンガーは加水分解には必要だがATPの結合には必要ないと結論づけられている。HslUのアルギニンフィンガーをグルタミン酸に変異させると,ATPの加水分解が阻害されるだけでなく,オリゴマー化も阻害される。
センサー2と3の残基
AAA+タンパク質の配列と構造を調べると、さらに2つの活性部位の特徴が明らかになった。
センサー2
1つ目はセンサー2で、ATPの結合と加水分解のサイクルに伴う構造変化を仲介する。これは一般的に、結合したATP分子のα-リン酸とセンサー2残基が直接相互作用することで起こる。この位置に変異があるとヌクレオチドの結合が弱くなるという報告と一致している。センサー2は、すべてのAAA+タンパク質でアルギニンまたはリジンとして保存されており、α7の始まり付近に位置している。AAA+ファミリーのメンバーとは対照的に、AAAファミリーのメンバーは一般的にセンサー2の位置にアラニン残基を持っている。センサー2は、C末端にリッドドメインを持つAAA+タンパク質ではシス作用残基として機能し、カノニカルなα-ヘリカルリッドドメインを持たないタンパク質ではトランス作用残基となる。
センサー3
センサー3と呼ばれる追加のセンサー残基が、AAA+の6量体ヘリカーゼであるパピローマウイルスE1とMCMタンパク質の構造に存在する。現在までに,このモチーフは,E1ではアルギニン,MCMではヒスチジンとして観察されている(図(c))。この残基は,ATP状態の安定化に役割を果たしている可能性がある。E1の構造では、サブユニットの界面を越えてWalker-Bのアスパラギン酸やSensor 1のアスパラギンと相互作用するトランス作用型のアルギニンが確認されている。
N-リンカー
α0のN-末端にあるAAA+ドメインには特徴的な部分がある。この領域には通常、保存されたグリシンまたは同様の小さな残基が含まれ、N末端でキャップを形成し、その後に別のファミリー保存された残基が続く。このジペプチド配列のN末端には,α-β-αコアのβストランドに垂直に走る保存領域がある。この領域は “N-リンカー “と呼ばれ、ATP結合ポケットに寄与するとともに、AAA+ドメインをタンパク質内の他のドメインに接続する役割を果たしている。N-リンカーはタンパク質のドメイン間に位置し、ATP結合部位に直接隣接していることから、このモチーフはATPの加水分解と構造変化のカップリングに直接的な役割を果たしていると考えられる。ヌクレオチド結合時にイソロイシン側鎖の位置が変わり、側鎖がATP結合ポケットから除外され、グリシン残基がコンフォーマルに変化することが明らかになった。
AAA+ファミリーの構造的特徴
すべてのAAA+ファミリーメンバーは、Walkerモチーフや第二相同領域などの共通の特徴を持っているが、これらのタンパク質の多くは、コアとなるα-β-αフォールドの内部または近傍に特定の二次構造要素を挿入している。その結果、AAA+ファミリーのメンバーは、特定の配列や構造の特性に基づいて細分化して分類されている。
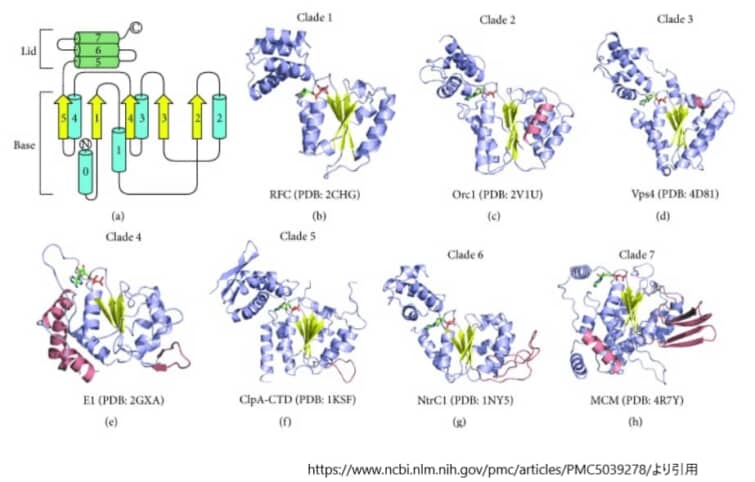
(a)最も単純なAAA+ドメインは、C末端にα-ヘリカルなリッドドメインを持つα-β-αトポロジーで特徴づけられる。ベースドメイン内のヘリックスとストランドはそれぞれ青色の円柱と黄色の矢印で示し、リッドドメインのヘリックスは緑色の円柱で表している。(b-h)各クレードの特徴的なメンバーの結晶構造を、ヘリックスとストランドをそれぞれ青と黄色に着色したカートゥーン表示で示す。各クレードを区別する挿入部分はサケで強調されている。それぞれの構造体には、棒状に示されたヌクレオチド分子が結合している。









