α-helix αヘリックスとは?
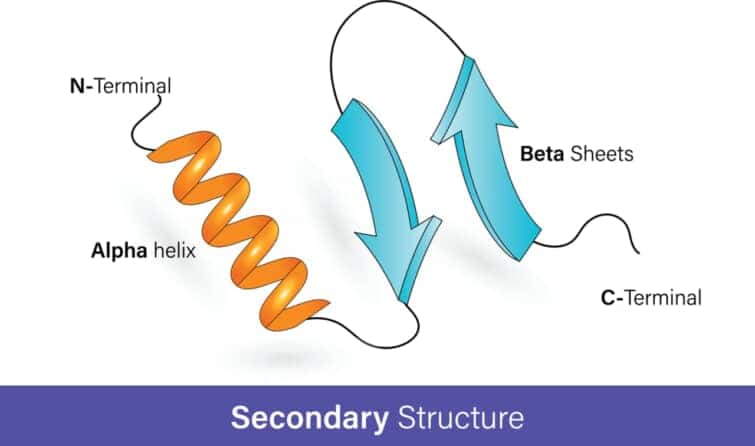
α-ヘリックス(alpha-helix)は、タンパク質の二次構造の一つで、ポリペプチド鎖が右巻きのらせん状に折りたたまれた構造を指します。この構造は、1951年にリンス・ポーリングとロバート・コリーによって初めて提唱されました。α-ヘリックスは、水素結合によって安定化されています。具体的には、ポリペプチド鎖の中のアミノ酸のカルボニル酸素(C=O)と、4残基離れたアミノ酸のアミノ水素(N-H)との間で水素結合が形成されます。
この水素結合パターンは、らせん構造全体にわたって繰り返され、構造の安定性と強度をもたらします。α-ヘリックスは、その柔軟性と強度のため、タンパク質の多くの機能的な役割において中心的な構造となっています。例えば、一部のタンパク質では、α-ヘリックスが酵素の活性部位の形成、タンパク質同士の相互作用、またはタンパク質が特定の分子を認識する際の構造的なフレームワークとして機能します。
さらに、α-ヘリックスは、膜貫通タンパク質においても重要な構造であり、これらのタンパク質が細胞膜を横断し、細胞内外の物質の輸送や信号伝達を担う際に中心的な役割を果たします。α-ヘリックスの構造的な特徴とその機能的な多様性は、生命科学において広範な研究の対象となっています。
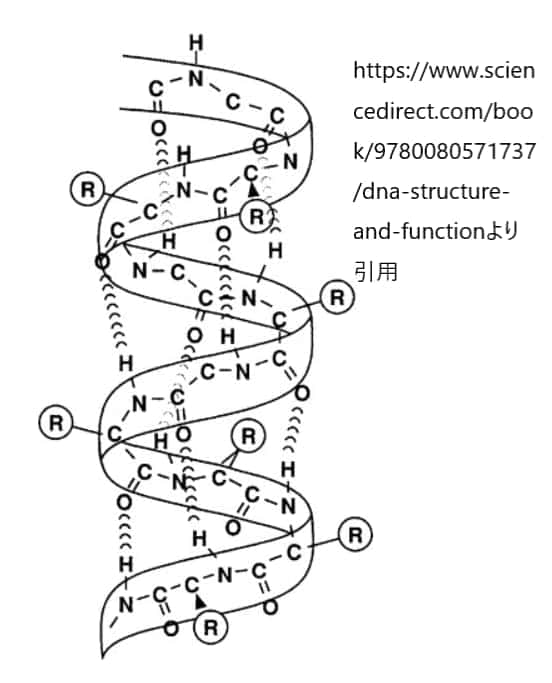
α-ヘリックスの構造においては、「3.6アミノ酸 1回転」という特徴が非常に重要です。これは、α-ヘリックスが1回転するのに3.6個のアミノ酸残基が必要であることを意味します。つまり、α-ヘリックスのらせん構造では、ポリペプチド鎖が約3.6個のアミノ酸ごとに360度回転しています。
この特性により、α-ヘリックス内では各アミノ酸のカルボニル酸素(C=O)と、4つ先に位置するアミノ酸のアミノ基(N-H)との間に水素結合が形成され、構造の安定化が図られます。この水素結合パターンはα-ヘリックスを通して一定であり、タンパク質のこの部分の構造を安定させています。
α-ヘリックスの「3.6アミノ酸 1回転」という特性は、タンパク質の構造と機能の研究において基本的な概念です。この規則的な構造により、α-ヘリックスは特定の長さや形状を持ち、タンパク質の構造的な多様性と機能性に寄与しています。このようにして、α-ヘリックスは生物学的プロセスにおける多くの重要な役割を果たすことができるのです。
α-ヘリックス構造は、タンパク質の主鎖が特定の方法で折りたたまれることによって形成される棒状の構造をしています。この構造において、アミノ酸の側鎖は主鎖のらせんから外側に向かって伸びているため、タンパク質の特定の機能や相互作用を可能にします。
α-ヘリックスの安定性は、主鎖のカルボニル酸素(C=O)とアミノ基(N-H)間の水素結合によって大きく支えられています。ここで重要なのは、ポリペプチド鎖の中の各アミノ酸のカルボニル酸素が、配列上で4つ先のアミノ酸のアミノ基と水素結合を形成するという点です。この水素結合パターンは、α-ヘリックス全体にわたって一貫しており、構造のコンパクトさと強度を保証します。
α-ヘリックスの構造的特徴は、その機能的多様性に直接関連しています。例えば、側鎖が外側に向かって伸びていることにより、これらの側鎖はさまざまな化学的性質を持つことができ、これによってタンパク質は特定のリガンドと結合したり、特定の生化学的経路において役割を果たしたりすることが可能になります。さらに、α-ヘリックスはタンパク質の中で膜を横断する部分としても機能することがあり、細胞内外の物質の移動やシグナル伝達に関与します。このように、α-ヘリックスはタンパク質科学において基本的かつ重要な構造要素の一つです。
αヘリックスの「スクリューセンス」には、右巻き(時計回り)と左巻き(反時計回り)がある。ラマチャンドランプロットによれば、右巻きと左巻きのαらせんの両方が許容される構造であるにもかかわらず、側鎖と主鎖の間の立体的な衝突が少ないため、エネルギー的には右巻きのαらせんの方が有利である。したがって、タンパク質のαヘリックスはすべて右巻きである。
タンパク質のα-ヘリックス構造における「スクリューセンス」、つまりらせんの向きに関して、理論的には右巻き(時計回り)と左巻き(反時計回り)の両方が存在可能です。しかし、実際にはほとんどの自然界におけるタンパク質のα-ヘリックスは右巻きです。これは、ラマチャンドランプロットを通じて理解されるタンパク質のアミノ酸残基の許容されるφ(ファイ)角とψ(プサイ)角の組み合わせに基づいています。
ラマチャンドランプロットは、タンパク質のアミノ酸残基が取り得るφ(Cα-N結合の周りの回転)とψ(Cα-C結合の周りの回転)の二つの主要な二面角の可能な値を示しています。このプロットは、特定の角度がアミノ酸の側鎖と主鎖の間で立体的な衝突を最小限に抑えることができる構造を示しています。
右巻きα-ヘリックスは、側鎖と主鎖の間の立体的な衝突が最も少なく、その結果、エネルギー的に最も安定した構造を提供します。このため、自然界におけるタンパク質では、右巻きのα-ヘリックスが圧倒的に一般的です。左巻きα-ヘリックスも理論的には存在可能ですが、実際には自然界のタンパク質構造内で観察されることはほとんどありません。これは、左巻き構造がエネルギー的に不利であるため、生物学的プロセスにおいては選択されにくいと考えられます。






