目次
染色体異数性、例えばダウン症候群を引き起こすメカニズムが徐々に解明されています。なぜ女性でこのような異数性が発生しやすいのかという問題について考察したレビューを紹介します。このレビューでは、染色体が正常に分配されないことによって起こる染色体の数に関する異常に焦点を当て、特に女性においてこの現象がなぜ頻繁に起こるのかを探っています。
www.ncbi.nlm.nih.gov/pmc/articles/PMC3551553/
内容をざっくりまとめると
このレビューは、ヒトの異数性発生に関連するさまざまな要因についての最新の知見をまとめています。主なポイントは以下の通りです:
多段階プロセス: ヒト異数性の発生は、卵形成の複数の段階で発生するエラーによる多段階プロセスであり、効率的なチェックポイントの欠如がこれを悪化させる可能性があることが示されています。
環境因子の影響: 特にビスフェノールA(BPA)などの内分泌かく乱化学物質が異数性発生に関与している可能性があり、これらの化学物質の曝露が卵子と胚の質に悪影響を及ぼす可能性が示唆されています。
生殖補助医療(ART)の影響: ARTに用いられる処置が異数性のレベルを増加させる可能性があることが指摘されており、特に卵巣刺激プロトコルと体外培養が卵子と胚の質に悪影響を及ぼす可能性があります。
ホルモンシグナルと内分泌撹乱物質の役割: 胎児卵巣における減数分裂の開始を制御するホルモンシグナルの役割と、これらのプロセスに影響を与える内分泌撹乱物質の影響についての理解が必要です。
自然妊娠とART妊娠の違い: 自然妊娠とART妊娠の間の違いが、受胎可能性の違いを反映しているのか、それともART手技による影響なのかを理解することが重要です。
このレビューは、ヒトの異数性体異形成の複雑さを浮き彫りにし、未来の研究と臨床戦略に豊かな土壌を提供しています。特に、胎児卵巣における減数分裂の開始の制御や、ART手技による影響など、今後の研究で解明すべき重要な疑問が提起されています。
アブストラクト
トリソミーやモノソミー(異数性)を持つ胚は、人間の妊娠の約10%を占め、年齢が高い女性ではその割合が50%を超えることもあります。この異数性の原因となるエラーは、大半が卵子の形成過程で起こります。しかし、集中的な研究が行われているにも関わらず、このエラーの根本的な分子的理由はまだ明確には理解されていません。最近の研究では、人間やモデル生物を用いた実験から、減数分裂の異常に関する新しい知見が明らかになりました。これらの研究により、女性の年齢が高くなるにつれてエラーが増える現象は、単一の原因ではなく、卵子の形成における独特な特性や、内外の様々な因子の相互作用によるものであることが示されています。
本文
トリソミー21がダウン症の原因として特定されてから50年以上が経過し、それによって臨床疾患と染色体異常との間の最初の関連が示されました。この半世紀の間に、ヒトの病理における染色体異常の重要性が広く認識され、多くの研究で詳細に記録されてきました。1960年代から1970年代にかけての新生児の調査では、約0.3%の新生児がトリソミーやモノソミーを持っていることが判明しました。しかし、その後行われた自然流産に関する研究では、流産胚の約35%がこれらの染色体異常を持っていることが明らかになり、これらの異常の実際の発生頻度がはるかに高いことが示されました。(表1)。これらの研究をまとめると、異数性が先天性異常や流産の主要な原因であることが分かり、ほとんどの異数性体が子宮内で生存できないことが証明されています。最近、生殖補助技術(ART)を使って得られた配偶子や着床前の胚を調査することで、異数性が妊娠成功の大きな障害であることが確認されました。特に、ARTにおける着床前遺伝子診断の進展は、異数性に関する研究に新たな方法を提供し、ヒト胚の異数性の程度を再評価するとともに、女性の減数分裂に対する環境要因の影響についての疑問に答えることを可能にしています。
初期の研究結果は、異数体が発生する主な原因が母体の減数分裂のエラーにあること、そして母体の年齢が上がると異数体が発生する可能性が高くなることを示しています。しかし、過去10年から15年の研究では、女性の卵巣内で卵子が減数分裂を始めた後、網糸期で停止し、受精するまでその状態が続くことが明らかになりました。この分裂までの期間は、10年から50年以上に及び、この長い時間がエラーの発生と蓄積のための十分な機会を提供します。これは、母体の年齢が異数体の発生に強く影響する多くの仮説の基礎です。実際に明らかになっているのは、異数性は単一の原因によるものではなく、子宮内での生命の始まりから女性の生殖寿命を通じて続き、年齢によって悪化する複数の要因が絡み合っていることです。これは、卵子の細胞周期制御の独特な特性によっても促進される複雑なプロセスです。
(図1)
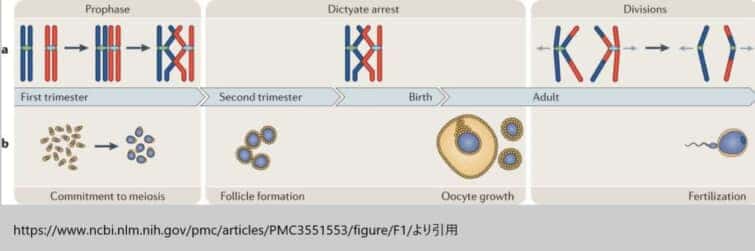
卵形成と女性の減数分裂周期
a|減数分裂。雌の減数分裂は時間的に3つの主要な段階に分けられます。まず、前駆期では、DNAの複製が行われた後、相同染色体(赤と青で表しています)がペアを組み、対合し、組換えを行い、そして網糸期で停止します。この網糸期の停止段階では、卵子は女性が成熟し、卵胞の形成に続く広範な成長期間を完了するまで、減数分裂が停止した状態を保持します。最後に、分割段階では、排卵を促す黄体形成ホルモンの急激な増加が減数分裂の再開を引き起こし、卵胞周囲の卵母細胞が最初の減数分裂を完了します。排卵された卵は、第二減数分裂のメタフェーズ(中期)で停止し、この第二減数分裂が完了し、アナフェーズ(後期)に進むのは卵が受精した場合に限られます。
b| 卵子形成。卵子の形成過程は複雑で、4つの異なる発達段階を含みます。最初に、減数分裂の開始は人の妊娠8〜10週目に起こります。次に、卵胞形成は妊娠の第2三半期に発生します。第三の段階として、卵子細胞の成長があり、これは性的に成熟した女性で、傍系および内分泌シグナルの制御下で起こります。この卵子細胞の成長期間は、ヒトでは約85日間とされ、通常は1個の卵子が排卵されることでクライマックスに達します。最終段階では、排卵された卵子が受精することで第二の減数分裂が完了します。この一連のプロセスは、卵子が成熟し、受精の準備が整うまでの複雑な生物学的経路を示しています。
以下のセクションでは、どのようにして現在の理解に至ったかについての証拠を検討します。まず、卵と胚に関する研究から得られた、ヒトの異数性体の発生率とその原因に関する最新の観察結果を要約します。これには、異数性がどれほど頻繁に起こり、それがどのようにして発生するかについての情報が含まれます。
続いて、性別による減数分裂細胞周期制御の厳格さの違いと、雌で見られるこれらのチェックポイントを回避するエラーのタイプについての新しい証拠に焦点を当てます。これにより、なぜ女性の卵子で異数性が発生しやすいのか、そのメカニズムについての理解が深まります。
最後に、ヒトにおける異数性体の発生率に影響を及ぼす可能性のある環境因子について検討します。これは、生活環境や外部からの影響が、異数性の発生にどのように作用するかを理解するための重要なステップです。この総合的なアプローチにより、異数性がどのようにして発生し、それがなぜ特定の状況でより一般的になるのかについての全体像を得ることができます。
異数体の頻度
子宮内での染色体異常妊娠の強い淘汰があるため、ヒトの異数性の「実際の」発生率を知るためには、受精卵の研究が必要です。自然妊娠では、このようなデータを得ることはできません。しかし、不妊治療を目的とした生殖補助技術(ART)の導入により、生殖細胞や初期胚の異数性のレベルを評価する新たな方法が提供されました。さらに、ARTを利用することで、不妊に悩むカップルが生殖の成功の可能性を高めるために、異数性の評価を活用しようとする動きも見られるようになりました。これは、異数性を特定し、可能な限り健康な胚を選択することで、妊娠成功率を向上させようとする試みです。
ART由来の妊娠における異数性
最初の細胞遺伝学的調査では、生まれてくる赤ちゃんや流産において、意外にも高いレベルの異数性が報告されましたが、多くの専門家はこれが氷山の一角にすぎないと考えていました。特に、妊娠6週以前の流産については研究が困難で、多くの異数性妊娠が妊娠初期に終わっていると推測されていました。不妊治療クリニックでの人の配偶子と着床前胚に対する最初の核型研究は、受胎時に少なくとも10~40%の異数性が存在することを示唆しており、この見解を支持しています。
1990年代には、従来の核型分析に代わって蛍光in situハイブリダイゼーション(FISH)ベースの分析が導入され、異数性の推定率が急上昇しました。しかし、FISHでは一般に限られた数の染色体しか分析されないため、この方法で検出される異数性率が従来よりも高いという結果には疑問が投げかけられています。実際、多くの研究で50%以上の異数性が報告されていますが、分析される染色体の数が限られているため、これらのデータは生物学的に考えられないほど高い全異数性のレベルを示している可能性があり、FISHベースの測定法が信頼できる推定値を提供できない可能性を示唆しています。
しかし、比較ゲノムハイブリダイゼーション(CGH)、アレイCGH、SNPアレイ解析などの他のゲノムベースの異数体検出法が開発されています。これらの技術の臨床利用はまだ始まったばかりですが、初期の結果は着床前胚の異数性率が20-40%であるとする従来の研究とより一致しており、臨床的に確認された妊娠と同様に、小さな染色体や端部着糸型染色体の染色体を含む異常が多いことを示しています。これらの新しい技術は、将来のART研究に対して楽観的な見通しを提供しています。
自然妊娠とART(生殖補助医療)妊娠の違い
自然妊娠から得られた観察結果がすべて生殖補助技術(ART)研究で再現されるわけではありません。一部の研究では、母体の第2減数分裂のエラーによる異数体の割合が、第1減数分裂のエラーに起因する割合を上回ることが示されており、異数体細胞には一本だけでなく、複数のトリソミーやモノソミーが含まれていることが一般的です。これは、自然妊娠のデータとは異なり、ほとんどの異数体異常が一本の染色体に起因し、特に母体の第1減数分裂のエラーに関連しているとされる観測とは対照的です。
妊娠の方法論の違いがこれらの矛盾を説明する手がかりを提供するかもしれません。自然妊娠におけるトリソミーの起源を研究する際には、親とトリソミーの子供のDNA多型を後ろ向きに分析する方法が取られます。一方、ARTでは、胚または極体の染色体含量を直接測定するゲノムベースのアプローチが採用されています。そのため、データの解釈にばらつきが生じます。例えば、自然妊娠の研究では、セントロメリのヘテロ接合性やホモ接合性を用いて減数分裂のエラー期間を推定していますが、ARTでは分離のエラーが明らかになる段階でのデータが提供され、これがイベント発生時を正確に反映していない場合があります。
また、不妊治療を受けているカップルが一般集団を代表していない可能性もあります。不妊患者には特有の生物学的違いが存在し、不分離の事象が特に増加しているか、あるいは不妊患者に限定されている可能性があります。さらに、選択圧により、複数のエラーを持つ胚が早期に死亡し、ARTへの移行が制限されることもあります。最後に、ARTに使用される一部の処置が不妊症のリスクを高める可能性があるという証拠が増えてきています。これらの要因を総合すると、ARTと自然妊娠の間で異なる異数体発生率が観察される理由がより明確になります。
減数分裂における性差
臨床的に確認された妊娠の研究からは、ほとんどのヒトの異数体異常が母体由来であることが示されています。これは、女性の減数分裂がなぜエラーを起こしやすいのかという重要な疑問を提起しています。このセクションでは、卵子の発生過程をレビューし、卵子における染色体異常を引き起こすエラーがなぜ増加するのか、そして減数分裂細胞周期のチェックポイントにおける性差がどのようにこれらのエラーを持つ卵子が成熟した卵子へと発育することを可能にするのかについての最近の証拠をまとめます。これらの研究から得られる一般的な結論は明確で、ヒトのトリソミー研究と一致しています。卵子形成における染色体の動きがどのように乱れるかには多くの方法があり、その結果としてヒトの異数性に至る道筋も多岐にわたります。これは、卵子の発達過程における複雑なメカニズムが異数性の発生に大きく関与していることを示唆しており、これにより女性の減数分裂がエラーを起こしやすくなる理由についての理解を深めることができます。
悪いスタート:組換えと異数分裂
哺乳類の雌の胎児期における卵巣での減数分裂的組換えは、染色体分離のための物理的な連結を形成する重要なプロセスとしてよく知られています。1990年代の研究では、組換えが失敗することや、交叉が最適でない位置にあることが、ヒトのトリソミーの主な原因であることが確認されました。これは、父性トリソミーと母性トリソミーの両方に関連していますが、ほとんどの異数性は卵巣形成期に発生するため、雌の方が明らかにリスクが高くなります。このことは、雌でより多くの組換えエラーが発生するか、あるいは雄でこれらのエラーがより効率的に淘汰されることを示唆しています。
免疫蛍光法を用いることで、パチテン期の精子細胞と卵子細胞内でクロスオーバーに関連するタンパク質を調査することが可能になりました。興味深いことに、男性のほとんどの染色体は少なくとも1つのクロスオーバーによって結合しているのに対し、女性ではそうではありません。実際、ヒトの全卵母細胞の10%以上が少なくとも1つの「クロスオーバーのない」二価体を含んでいるとされ、これらの二価体の半数が異数性体になると予想されています。これは、卵子形成の初期段階から、減数分裂エラーの可能性が高まっていることを示しています。
男女間で組換えの障害に対する感受性が異なることも別の疑問を提起します。哺乳類の組換えホットスポットを媒介する分子プレーヤーと、雌雄で異なる機能を持つ組換え遺伝子が最近になって明らかにされています。しかし、組換えのレベルがいつ「設定」されるのかや、クロスオーバーの染色体の位置が雌雄でなぜ異なるのかについては、まだ十分に理解されていません。染色体分離の正常な進行を保証するためにクロスオーバーが果たす重要な役割を考慮すると、交換パターンを制御する性特異的なシグナルの理解が不可欠です。
プロフェーズ(前期)チェックポイント制御の性差
体細胞におけるG2/Mチェックポイントは、DNA損傷がある場合にメタフェーズへの移行を防ぐ役割を果たします。酵母と哺乳類の研究から、減数分裂細胞でも同様のチェックポイントが機能しており、プログラムされたダブルストランドブレイクの修復が妨げられると、減数分裂細胞が死滅する可能性があることが示唆されています。減数分裂細胞は体細胞よりも複雑で、相同染色体間の対合が追加の制御レベルを導入しています。
マウスにおける研究は、減数分裂期の対合異常がオスでは精子細胞の死滅を引き起こすことを示していますが、メスは多くの突然変異に直面しても受胎可能性を保持しています。この性差の理解は、対合不全が未対合の染色体領域の転写サイレンシングにつながることを認識することで深まっています。オスでは、性染色体間のシナプスが限られており、X染色体とY染色体の未シナプス領域の転写サイレンシングが起こります。これは減数分裂性染色体不活性化(MSCI)として知られ、様々なメカニズムによって達成されますが、性染色体不活性化は広く保存されています。
MSCIは男性の受胎に不可欠であり、未経過クロマチンに対する性別間の感受性の違いに説得力ある説明を提供しています。しかし、未対合の常染色体にも同様のサイレンシングメカニズムが作用するため、実際の状況はより複雑です。これは未対合クロマチンの減数分裂サイレンシング(MSUC)として知られ、雌雄で発生します。オスでは、性染色体の前に未対合の常染色体が転写的にサイレンシングされます。これは、性染色体の不活性化の失敗が男性不妊の主な原因である可能性があることを示唆しています。
一方で、メスでは非対合の常染色体領域の転写サイレンシングが有害である可能性がありますが、性染色体サイレンシングの要件がないため、影響はより穏やかです。対合を阻害する突然変異を持つマウスの研究は、対合不全が一部の卵子を排除する結果となることを示していますが、多くの場合、女性の受胎可能性は維持されます。これは、雌の太糸期チェックポイント機構がそれほど厳しくなく、減数分裂中の性染色体活性の違いが性別間の違いの根底にある可能性が高いことを示唆しています。
母体年齢とともに増加する非接合性:コヒーシンが原因?
精子形成と卵子形成の間で最も明確な違いの一つは、パチテン後の進行速度にあります。男性の配偶子は減数分裂の残りの部分を迅速に進行するのに対し、卵子は前期の後期段階で長期間停止します。この停止は、マウスでは数週間から数ヶ月、ヒトでは数十年に及ぶことがあります。
加えて、ヒトの女性における減数分裂は、母体年齢と卵子の遺伝的品質との間の複雑な関係によってさらに複雑化されます。自然発生の妊娠におけるトリソミーの発生率を示す母体年齢曲線は、最も若い母親の年齢でわずかに増加し、閉経前の10年間で指数関数的に増加してJカーブを描きます。これは、老化が染色体の分離に複数のメカニズムを介して影響を与えることを示唆しています。
このセクションでは、そのメカニズムの一つである姉妹染色体の凝集力の喪失に焦点を当てます。姉妹染色体の凝集力の連続的な喪失は、相同体間の結合を確立できないことが、ヒトの異数性の主要な原因の一つとして長く提唱されてきました。しかし、相同染色体間の結合の早期喪失もまた重要な原因である可能性があり、これは姉妹染色体の凝集力の喪失によるものかもしれません。例えば、相同染色体がクロスオーバーによってのみ結合している場合、交叉点を超えた凝集力の喪失は相同染色体の結合を解除する可能性があります。
胎児の卵巣で減数分裂前のS相中に確立されるコヒーシンは、成人の長引く減数分裂停止中に凝集力の低下がヒトの母体年齢効果の基礎であるという考えを支持しています。雌ショウジョウバエの研究や、特定のコヒーシン構造維持機構に変異を持つマウス(Smc1b)の研究は、加齢に伴うコヒーシンの喪失と、それが異数性レベルの増加につながる可能性を示唆しています。これらの発見は、加齢と減数分裂の精度の間に直接的な関連があることを示唆し、母体年齢が卵子の遺伝的品質に与える影響の理解を深めています。
結束力の喪失が母体年齢効果の根底にあるという仮説は、胎児の発育中に減数分裂染色体にロードされるコヒーシン複合体のタンパク質が、その後のターンオーバーがないことを前提としています。しかし、成長中の卵母細胞で減数分裂特異的なコヒーシン転写物が検出されていることから、卵巣形成中にコヒーシンタンパク質が補充される可能性が示唆されています。
この点について、2つの相補的なマウス研究が重要な洞察を提供しています。一つ目の研究では、卵母細胞特異的にSmc1bをノックアウトすることで、胎児卵巣では減数分裂特異的コヒーシンの正常な合成が確認されましたが、成体卵巣の成長中の卵母細胞では新たなタンパク質合成は見られませんでした。二つ目の研究では、減数分裂特異的コヒーシンREC8が分析され、成長中の卵巣で合成されたREC8が、胎児期にロードされた後、実験的に破壊されたタンパク質を補充できるかどうかが検証されました。
これらの研究結果は一致しており、胎児期に染色体にロードされたコヒーシンが成熟した卵子において凝集力を媒介するのに十分であるということを示しています。これは、成熟した卵子の品質と母体年齢効果との関連において、コヒーシンのロードと保持が重要な役割を果たしていることを示唆しています。この発見は、卵子の品質が時間とともにどのように変化するか、また、高齢の母体で見られる妊娠関連の問題の一因となる可能性がある結束力の喪失のメカニズムに光を当てています。
マウスモデルとヒト卵母細胞の研究を統合することで、コヒーシンの喪失が減数分裂不分離の重要なメカニズムであることが示されています。しかし、年齢効果の唯一の根拠ではないことを示す証拠もあります。特に、ヒトのトリソミー研究からは、単一の非接合メカニズムがすべての染色体に適用されるわけではないことが明らかにされています。この違いは染色体の大きさによるものではなく、もしコヒーシン欠損が唯一の原因であれば、そうなることが予想されます。
組換えの失敗は高齢の女性において発生するトリソミーと関連していることがありますが、すべてのトリソミーに該当するわけではありません。加齢による凝集力の喪失は、特定の状況(例えば、小さな染色体が単一のクロスオーバーで結合している場合)では魅力的なメカニズムである可能性がありますが、組換えの失敗や複数のクロスオーバーで結合している染色体、近位のクロスオーバーで結合している染色体など、他の状況では該当しない可能性があります。
このように、ヒトにおける母体年齢効果に寄与する複数のメカニズムが存在することが示されています。これは、異数性の発生に複数の要因が関与していることを示し、高齢母体における妊娠関連の問題を理解するための複合的なアプローチが必要であることを強調しています。さまざまなメカニズムがどのように相互作用し、特定の染色体異常が発生する条件をどのように形成するかについてのさらなる研究が求められています。
マウスとヒトの間で染色体異常率や生殖寿命に違いがあることは、仮説を種をまたいで拡大する際の注意を要します。マウスの受精卵における異数性の基本レベルはヒトに比べて格段に低く、また母体年齢の影響もヒトほど顕著ではありません。このため、マウスからヒトへの直接的な外挿は、これらの種間の違いを考慮する必要があります。
老化マウスにおける凝集力の喪失に関する最近の研究では、不分離の増加が生殖的に老年期のメスでのみ顕著であったことが示されています。これは、ヒトのトリソミーの加齢に伴う増加が閉経の少なくとも10年前から始まることとは対照的です。これらの違いから、マウスのデータをヒトの状況に適用する際の限界が浮き彫りになります。
さらに、年齢の異なる女性の卵子における減数分裂のコヒーシンレベルに顕著な差が認められなかったという、ヒトに関する唯一の研究は、コヒーシンの著しい減少がヒトでは起こらない可能性があることを示唆しています。しかし、これはコヒーシンの喪失が染色体不分離の主要な原因ではないことを意味するものではなく、単にヒトの異数性における複雑さを反映している可能性があります。
これらの点を踏まえると、コヒーシンの喪失がヒトの閉経前の10年間に観察される染色体不分離の急増を駆動する唯一の要因であると考えるのは難しいと思われます。停止期間の長さ、不分離パターンの複雑さ、および年齢の影響を考慮した総合的なアプローチが、ヒトの異数性の理解を深める鍵となります。これは、ヒトの母体年齢効果に寄与する複数のメカニズムが存在することを示唆し、異数性研究におけるさらなる探求を促します。
姉妹の解放:正常な結束力の喪失と早すぎる結束力の喪失

a|正常な状態。姉妹染色体間の結合は、減数分裂前のS期に確立され、オレンジ色のリングで示されることがあります。組換えが行われた後、交換部位の遠位にある凝集体は、ジクチル酸の停止中に相同体を結びつける役割を果たします。最初の減数分裂の間、染色体の腕に沿った凝集力は解放されますが、姉妹染色体のセントロメアでの凝集力は保持されます。これにより、姉妹染色体間のセントロメア接続を維持しつつ、相同染色体が分離することが可能となります。2回目の減数分裂では、残っているセントロメアの結合が切断され、これにより姉妹染色体が分離することができます。このプロセスは、アナフェーズIの段階で、2つのホモログのうち1つだけが分離する様子を示しています。
b | 腕の凝集力の早期喪失。アナフェーズIの前に交換部位の遠位での凝集力が失われると、同族体が早期に2つの対をなした一価体に分離し、減数分裂Iで互いに独立して分離することになります。このプロセスが発生すると、減数分裂IIの間に各相同体の姉妹染色体が分離し、結果として余分な染色体を持つ卵子(および第二極体)が生成されることになります。
c | 早期に失われた中心体の凝集力。姉妹染色体のセントロメア間の凝集力の損失は、減数分裂Iまたは減数分裂IIのどちらかで発生する可能性があり、この凝集力の損失は姉妹染色体のセントロメアがランダムに分離することにつながります。通常、減数分裂Iでは相同染色体が分離し、減数分裂IIでは姉妹染色体が分離します。しかし、姉妹染色体のセントロメア間の凝集力が早期に失われると、減数分裂Iで早まったり、不規則な姉妹染色体の分離が減数分裂IIで発生したりする可能性があります。
紡錘体チェックポイント:最終ゲートキーパー
相同染色体間の結合が維持できない場合、組換えの失敗や姉妹染色体の凝集力の低下が原因となり、これが最初の減数分裂時に一対の一価体の存在につながります。第一減数分裂時に一価体に課せられた制約は、これらが紡錘体に安定した二極接着を形成する能力を阻害します。細胞がアナフェーズを開始する前にすべての染色体が安定した双極性接着を達成し、紡錘体の赤道に整列する必要があるという細胞周期制御の原則に基づくと、1本でも整列していない染色体が存在すると、紡錘体チェックポイント(SAC)が活性化され、アナフェーズの開始が遅れることになります。そのため、単極性のアタッチメントしか形成できない一価体の染色体の存在は、SACを活性化し得るものです。
しかし、第一減数分裂中期における染色体の挙動に対する減数細胞の反応は性に特異的であることが示唆されています。雄マウスでは、1本の一価体の染色体の存在が頑健な反応を引き起こし、第一減数分裂中期の停止と初代精母細胞の死につながります。これに対して、雌では最初の減数分裂でのSAC制御が比較的非効率的であり、パキテンチェックポイント機構と同様の傾向が見られます。実際、雌マウスでは一価体の存在が後期に進むことを妨げず、これらの異常染色体の存在が細胞周期の遅延を引き起こすことも検出されません。
この性差は、雌雄で減数分裂の制御メカニズムが異なることを示唆しており、雌の生殖細胞が一価体の存在による細胞周期の遅延に対してより寛容であることを示しています。この違いは、異数性配偶子の形成における性別特有のリスク要因を理解する上で重要な意味を持ち、雌雄間での生殖細胞の分裂と染色体挙動の管理における基本的な違いを浮き彫りにします。
雌においては少なくとも2つの要因がチェックポイント回避の鍵を握っていると考えられる
要因1:一価の染色体の挙動とSAC制御の違い
雌マウスの研究から、一価染色体が減数分裂I型紡錘体に双極性の付着を行い、SAC(紡錘体チェックポイント)の要件を満たすことが可能であることが示されています。シナプトネマル複合体タンパク質3(Sycp3)が欠損している雌マウスや、クロスオーバー関連遺伝子mutLホモログ1(Mlh1)のヌル変異のホモ接合体である雌マウスにおける複数の一価体の分析は、これらの一価体が第一減数分裂後期に進む前に双極性アタッチメントを形成できることを示しています。
特に、XO雌マウスにおける単一X染色体の挙動は、姉妹染色体が分離するか、あるいは最初の減数分裂時に無傷で分離するかのいずれかであることが長年にわたって認識されてきました。Mlh1突然変異体とXO雌マウスの両方において、一価染色体が第一減数分裂期の紡錘体に双極性のアタッチメントを形成する能力は遺伝的背景に依存していることが注目されます。
重要なのは、最初の減数分裂での双極性付着がSACを回避できる可能性があるものの、最初の減数分裂での姉妹染色体の早期分離は第二減数分裂での異数性化を引き起こす可能性があるという点です。これは、減数分裂細胞の挙動に関する我々の理解を深め、特定の遺伝的背景が減数分裂不分離のリスクにどのように影響を与えるかについての洞察を提供します。また、異数性配偶子の形成に至る複雑な過程と、それが生殖成績に与える影響を理解する上での重要な情報源となります。
アナフェーズ促進複合体(APC)と紡錘体チェックポイントSACタンパク
哺乳類の雌において、紡錘体チェックポイントSACが雄よりも「弱い」という説得力のある証拠があります。また、一部の染色体の安定した付着だけでSACの要件を満たすことができるという事実も示されています。これは、紡錘体チェックポイントSACを介した制御に関与するタンパク質が卵母細胞に存在し、紡錘体異常や多数の一価染色体が雌の第一減数分裂中期の停止を引き起こすことを意味します。しかし、すべての染色体が紡錘体の赤道に適切に整列していることは、卵子が第一減数分裂後期に進むための必須条件ではないことが最近の研究で示されています。
これらの観察結果は、染色体のずれの発生率が異数性の発生率の増加と相関していることを示すマウスやヒトの他の研究結果と一致しています。また、卵母細胞では、細胞周期の構成要素が異なる形で使用されていることが示唆されています。特に、メタフェーズからアナフェーズへの進行には、アナフェーズ促進複合体(APC)の2つの異なる形態間の適切な遷移が必要です。APC-カドヘリン1(APC-CDH1)は通常、有糸分裂細胞で前相の間にのみ活性化され、卵母細胞ではプロメタフェーズIの染色体進行を制御します。一方、アナフェーズの開始にはAPC-CDC20(細胞分裂周期20ホモログと複合化したAPCのバージョン)の作用が必要であり、この遷移はSACタンパク質BUBR1の作用によって達成されます。
重要なのは、これらの複合体のどちらかが機能しなくなると、異数性の発生率が増加するという事実です。これは、卵子の品質と染色体の正確な分離において、これらの複合体が果たす重要な役割を強調しており、異数性の発生に対する理解を深める上での重要なポイントとなります。このようなメカニズムの理解は、生殖生物学や遺伝学の分野におけるさらなる研究の方向性を示唆しています。
卵子への環境の影響
喫煙、飲酒、経口避妊薬の使用、放射線被曝などの環境因子がヒトの異数性体を誘発する可能性については、長年にわたり多くの研究が行われてきましたが、これらの因子が異数性に直接関与しているという確固たる証拠はまだ見つかっていません。しかし、過去10年間にマウスを使用した実験研究や生殖補助技術(ART)に関連するデータの蓄積から、内分泌かく乱化学物質や外因性ホルモンと異数性の発生との間に関連性があることを示す説得力のある証拠が得られています。
内分泌かく乱化学物質は、生物の内分泌システムに影響を与える化学物質で、ホルモン様の作用を持つため、生殖機能に影響を及ぼす可能性があります。例えば、特定の農薬、プラスチック製品に含まれるビスフェノールA(BPA)や、一部の化粧品に含まれるフタル酸塩などが内分泌かく乱化学物質として知られています。これらの化学物質の曝露は、生殖細胞の正常な発達を妨げ、異数性の配偶子を生成する可能性があります。
マウスモデルを用いた研究は、これらの化学物質が染色体の正常な分離プロセスに干渉し、結果として異数性が発生するメカニズムを明らかにするのに役立っています。さらに、ARTに関するデータは、生殖におけるこれらの化学物質の影響を評価するのに有用な情報を提供しています。
これらの研究成果から、環境因子と異数性の関連性をさらに理解するためには、以下のような追加データが必要です:
長期的な曝露研究:特定の化学物質への長期曝露が異数性に与える影響を評価する。
人間における疫学研究:大規模な人口集団を対象とした研究で、環境因子と異数性発生との関係を詳細に調査する。
分子メカニズムの解明:内分泌かく乱化学物質が細胞の分裂メカニズムにどのように干渉するかを明らかにする研究。
これらのデータは、特定の環境因子がヒトの生殖へ与える影響をより深く理解し、将来的には生殖健康を保護するための対策を講じるための基盤となります。
内分泌かく乱物質と異数性:BPAの話
ビスフェノールA(BPA)の研究は、環境曝露と異数性障害との間に最も強い関連性がある可能性が示唆されています。BPAは内分泌かく乱化学物質であり、ヒトが日常的に接触している可塑剤の一つです。マウスを用いた減数分裂研究での偶発的な暴露から、BPAが異数性を誘発する可能性があることが示唆されました。その後の研究では、雌マウスを低レベルのBPAに曝露すると、減数分裂染色体の挙動が乱れることが確認されていますが、これがどのようにして異数卵子の発生につながるかについてはまだ議論があります。
紡錘体チェックポイントSACは、BPAによって誘発された染色体整列障害を示す卵母細胞の細胞周期停止と死を引き起こしますが、異数卵子は発生しないと主張されてきました。しかし、異なるメカニズムによって誘発される染色体整列障害と異数性卵子の増加との関連がマウスで報告されています。BPAは卵胞の成長に影響を与え、生殖補助を受けている女性においては、卵子採取に使用される刺激方法を阻害することが示唆されています。
また、BPAは卵母細胞の発達の初期段階を破壊し、減数分裂の前段階でのシナプスと組換えを変化させ、成体の雌の減数分裂エラーの発生率を増加させることが示唆されています。BPAがエストロゲン受容体ERβの作用を阻害することが示唆されており、これが卵子形成の開始の制御に影響を与える可能性があります。これらの障害は胎内で発生する可能性があり、成人になるまで顕在化しないため、ヒトでの因果関係を証明することは難しいです。
これまでのところ、BPAがヒトにおける前相イベントを乱すという示唆は、培養胎児卵巣組織のin vitro暴露の研究から得られています。マウスとワームの研究で得られた知見との間に顕著な類似性があることから、BPAの影響に関する懸念が強調されています。これらの知見は、環境因子が人間の生殖へ与える影響を理解する上での重要な手がかりを提供し、さらなる研究の必要性を示唆しています。
生殖補助医療ARTにおける卵巣刺激プロトコルと卵巣異能症
生殖補助医療(ART)による妊娠における異数体妊娠のメカニズムや原因の一部は、この集団に特有のものであると考えられています。特に、不妊症の人々を対象としたヒトの卵子や胚の研究からは、エラー率が本質的に高い可能性があることが示唆されています。さらに、ARTに用いられる処置が異数性のレベルを増加させる可能性があることも指摘されています。具体的には、卵巣刺激プロトコルと体外培養が卵子と胚の質に悪影響を及ぼす可能性があるという証拠が蓄積されてきました。これらの影響の多くはエピジェネティックな変化と関連しており、卵子の成長過程でのメチル化やインプリンティングされた遺伝子の発現の変化が、ARTによって影響を受ける可能性があると示されています。
外因性ホルモンがヒト異数性体の発生に関与している可能性を示すデータは比較的新しいものですが、避妊ピルの導入に関連する染色体異常妊娠の増加や、卵巣刺激プロトコルがマウスの卵子の染色体異常率を増加させることが示唆されていた初期の細胞遺伝学的研究など、この考え自体は新しくありません。内分泌環境の変化が自然妊娠で見られる異数性の増加の根底にあると仮定されています。
ARTの導入により、刺激プロトコルの改良が必要とされており、特定の卵巣刺激レジームに関連する高い異数性化率を示唆する初期のデータがあります。近年では、卵子採取に使用される刺激プロトコルが卵子の質に悪影響を及ぼす可能性があると懸念されており、「自然周期」やマイルドな刺激プロトコルの使用が実験的に行われています。これらの新しいプロトコルと確立されたプロトコルの比較研究からは、ゴナドトロピンの低用量が低い異数性率と相関していることを示す人間における最初の直接的な証拠が得られています。
これらの発見は、卵子の成長と成熟を制御するホルモン信号の相互作用が人間の異数性の生成に重要であることを示唆しています。アレイベースのアプローチの開発は、これらの環境変数の影響を直接テストする感度の高い手段を提供し、ARTのさらなる改善に希望を与えています。
結論と今後の方向性
このレビューが示しているのは、ヒト異数性の発生には、さまざまな “ヒット”が関与しており、これらが複数の卵形成の段階で協力してエラーの頻度を増加させる可能性があるということです。胎児の卵巣で発生するイベントが相同染色体間のプロトフェーズの相互作用に影響を与え、女性の長いプロトフェーズの停止が減数分裂機械のコンポーネントの年齢依存的な減衰を通じて異数性に寄与する可能性があること;そして環境の影響が異数性の発生に寄与するために、卵巣形成のさまざまな段階で作用する可能性があることが示唆されています。
提起された2つの疑問は、今後の研究の方向性を示しています。
ホルモンシグナルの役割と内分泌撹乱物質の影響: 胎児卵巣における減数分裂の開始を制御するホルモンシグナルの役割と、これらのプロセスに影響を与える可能性のある内分泌撹乱物質のタイプに関する理解は、女性の減数分裂の両段階を制御するホルモンシグナルの理解を深めることが重要です。環境要因と異数性との関連性を探ることは、生殖健康への影響を理解し、適切な予防策を講じるために不可欠です。
自然妊娠とART妊娠の間の違い: 自然妊娠とART妊娠の間に見られる違いが、受胎可能な個人と受胎不可能な個人の違いを反映しているのか、それとも生殖補助医療ART手技によって誘発されているのかを理解することは、治療方法を改善し、異数性障害を予防する新しい臨床戦略を設計するために重要です。
これらの問いに対する答えを見つけることは、ヒトだけでなく他の種の生殖健康に対する理解を深めることにつながります。特に、幹細胞から機能的な配偶子を作製するための培養系の開発と改良に対する関心が高まっていますが、この分野の研究者は減数分裂のプロセスと性別の違いを完全に理解することが成功の鍵となることを認識する必要があります。これらの新たな疑問と知見は、生殖医療の未来を形作る上での豊かな研究の土壌を提供します。






