目次
セントロメア
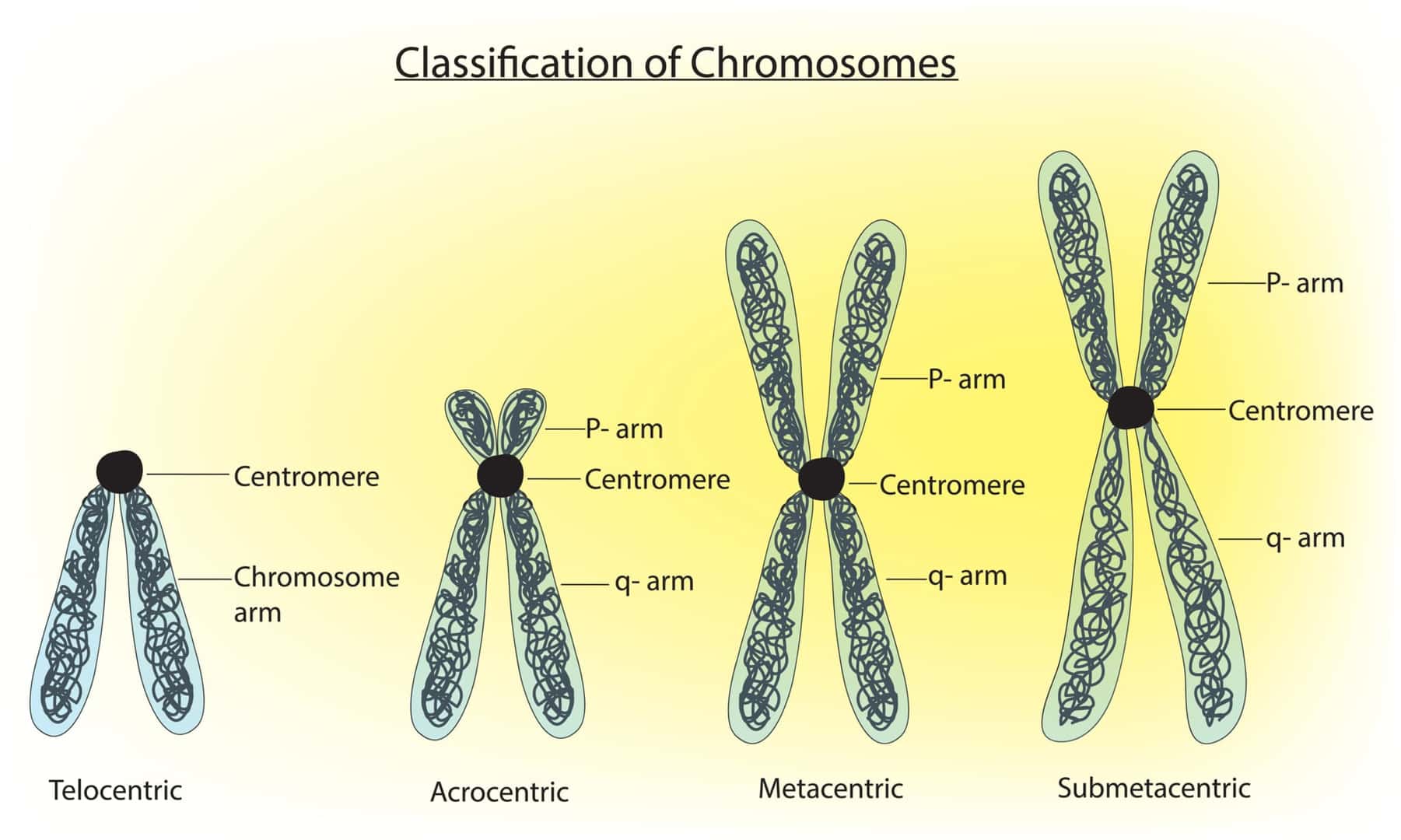
セントロメア(Centromere) とは染色体の長腕と短腕が交差する部位をいう。
染色体のほぼ中央に位置するためこの名称になっているが、短腕が凄く短くてセントロメアが中心にない染色体もある。セントロメアは細胞分裂するときには紡錘体が結合する大事な部分となっている。凝集したクロマチン構造(ヘテロクロマチン)をとり、遺伝子発現自体は構造的に抑制されている。DNAの塩基配列はセントロメア特有の繰り返し配列になっている。
細胞分裂において、複製した姉妹染色体を分配のするときに紡錘体が動原体を介して結合するのがセントロメアである。ところが、セントロメア領域のDNA配列に特異性はなく、どの領域が当該染色体のセントロメア領域なのかについてはエピジェネティックに決定されている。セントロメアのエピジェネティックマーカーとしてヒストンH3のバリアントであるCENP-Aがあるが、CENP-A単独で動原体活性を発揮できない。(関連記事:動原体))
セントロメアは、細胞分裂によって染色体が確実に継承されるための染色体の位置である。染色体を紡錘体の微小管に結合させる複数のタンパク質構造体であるキネトコアは、細胞分裂の際に染色体の移動を局所的に調整するためにセントロメアに集まっている。染色体には必ず動原体が必要で、動原体がないと染色体が失われ、染色体の本数に異常がある異数性の核型になってしまう。すべての生物のゲノムの安定性に重要な役割を果たしている遺伝子座は、生物間で類似したゲノム特性を示すことが期待される。驚くべきことに、セントロメアDNAは生物間で、さらには同じ生物の異なる染色体間でも異なる。
セントロメアの大きさは、125bpまでという出芽酵母の小さなポイントセントロメアから、100kb~5Mbという巨大なヒトや植物の大きなセントロメアまでさまざまである。このような配列の違いにもかかわらず、真核生物のセントロメアのタンパク質は関連しており、この遺伝子座の機能的重要性が強調されている。セントロメアは、ヒストンH3バリアントであるCENP-Aを含む特殊なヌクレオソームによって定義される。CENP-Aのヌクレオソーム群は、通常のH3ヌクレオソーム群と混在しており、セントロクロマチンとも呼ばれる独特のセントロメリック(CEN)クロマチンを形成し、染色体の他の部分とセントロメアを区別している。CENクロマチンは、CENP-Cや構成的セントロメア関連ネットワーク(CCAN)の他のメンバーと相互作用し、インターフェースとしてDNAと微小管の間のタンパク質ネットワークを組み立てることで、動原体付着の基礎となる。つまり、CENP-Aや他のセントロメアタンパク質には配列特異性がないことを示唆しており、CENP-AやCENクロマチンがセントロメアの同一性や維持に重要なエピジェネティックな決定因子であることを示している。真核生物のセントロメアには配列の類似性が見られないことから、セントロメアの同一性はエピジェネティックなプロセスであり、基礎となるDNAからの寄与はほとんどないというのが現在の見解である。
ほとんどの生物のセントロメアは、特定のDNA配列によってではなく、エピジェネティックに定義される
ほとんどの生物のセントロメアは、特定のDNA配列によってではなく、エピジェネティックに定義されている。長い年月をかけて、エピジェネティックにセントロメアのアイデンティティを決定する重要な因子を探すうちに、CENP-A(CenH3)が発見された。CENP-Aは、ヒストンH3のバリアントである。CENP-Aは、他のすべてのキネトコア構成要素のキネトコアへのリクルートに必要である。
セントロメアがエピジェネティックに指定される概念は、DNAの定義されたセグメント上のCENP-Aの存在が、ほとんどDNAの配列に依存せず、しかも極めて安定しており、その特定の遺伝子座(セントロメア)で複数の細胞世代にわたって自己増殖するという事実に関連している。
なぜほとんどの種のセントロメアはエピジェネティックに規定されているのか?
細胞分裂に不可欠な役割を果たしているにもかかわらず、なぜほとんどの種のセントロメアはエピジェネティックに規定され、DNA配列が大きく異なるのか。また、なぜ活性化したセントロメアには繰り返しのDNA配列が蓄積されるのか?これらの疑問に対する明確な答えはまだ得られていない。現在考えられているいくつかの仮説は以下のとおりである。
セントロメア駆動仮説は、卵母細胞においては減数分裂時にゲノムの4分の1だけが卵に伝達され、残りは極体で廃棄されるという染色体分離の非対称性が、遺伝的対立を引き起こし、セントロメアの急速な進化を促進するという仮説である。この仮説は,セントロメア/キネトコアタンパク質の適応進化の証拠や、セントロメアリピートに変異があるマウス系統のセントロメア活性の分析から支持されている。
これとは別の考えとして、キネトコアのアセンブリーの基盤には、配列の制約ではなく、主に構築的な制約によって定義されるクロマチン状態が必要であり、それによって特定の配列を維持するための選択圧が軽減されるというものがある。このようなクロマチン構造が分裂によって継承されるのであれば、減数分裂時に非対称な分離を行わない種でもセントロメアの変異を説明することができる。
セントロメアにおけるリピートの存在に関する疑問については、リピートを持たないネオセントロメアは、誤分配に対してより敏感であり、エラー修正機構の局在量が少ないことが示されており、リピートが染色体分配の精度に関与していることが示唆されている。反復配列がヘテロクロマチン形成の引き金となり、その結果、コヒーシン複合体の濃縮が促進され、セントロメアが機械的に強化されるとともに、エラー修正装置の局在化が促進されるというモデルも考えられている。このようなモデルは、最適なセントロメアの機能と反復配列の蓄積を結びつけるものであり、なぜ異なる種のセントロメアで反復配列が独立して蓄積したのかを説明できる可能性がある。
セントロメアに結合するタンパク
哺乳類のセントロメアに結合するタンパク質は、細胞周期中の空間的な位置関係に基づいて2つのグループに大別される。
1.セントロメアに構成的に結合しているタンパク質
第一のグループは、CENP-A、CENP-B、CENP-Cのようにセントロメアに構成的に結合しているタンパク質で、キネトコアの形成に構造的な役割を果たしていると考えられている。
CENP-Bは有糸分裂や減数分裂の際のセントロメアの機能には必須ではないことが示されている。
2.パッセンジャータンパク質
2番目のクラスは、パッセンジャータンパク質と呼ばれ、細胞周期中に一過性にセントロメアに結合し、紡錘体の捕捉、メタフェースからアナフェースへの移行、姉妹クロマチンの結合など、細胞分裂において様々な役割を果たすタンパク質から構成される。
この記事の著者:仲田洋美医師
医籍登録番号 第371210号
日本内科学会 総合内科専門医 第7900号
日本臨床腫瘍学会 がん薬物療法専門医 第1000001号
臨床遺伝専門医制度委員会認定 臨床遺伝専門医 第755号






