目次
本記事では、ヒストンの構造、機能、およびエピジェネティックな修飾について詳しく解説します。また、ヒストン修飾がどのようにして細胞の遺伝情報の利用を制御し、疾患の発生にどのように関与しているかを学ぶことができます。
第1章: ヒストンとは
ヒストンの基本構造
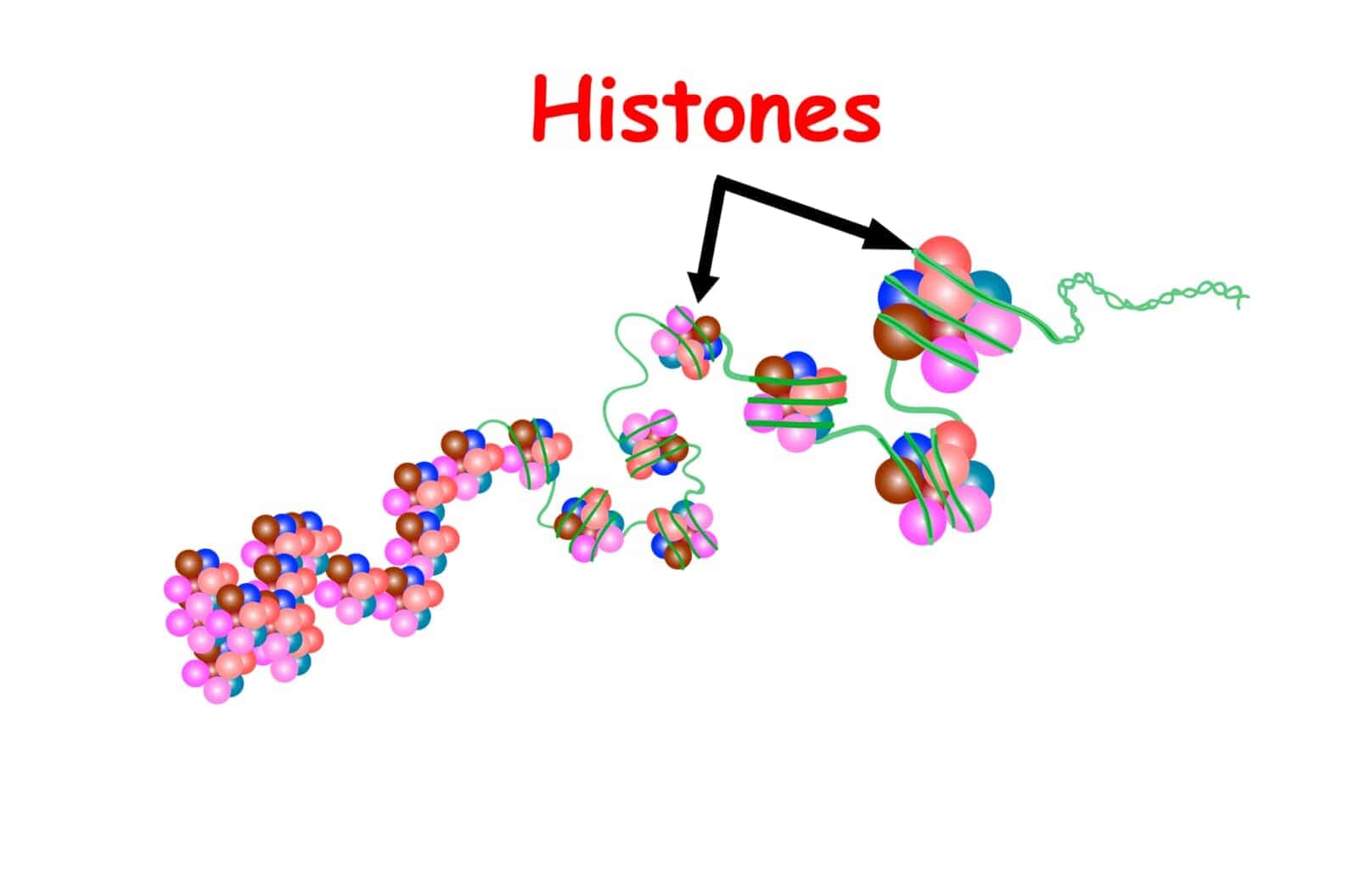
ヒストンは、真核生物の核内に存在する塩基性タンパク質であり、DNAを巻き付けることによってクロマチンの基本構造であるヌクレオソームを形成します。ヒストンは主に5種類(H1、H2A、H2B、H3、H4)が存在し、これらは構成するアミノ酸の約20%がリジン、アルギニンから成る塩基性タンパク質です。H2A、H2B、H3、H4の4種類は2分子ずつ含む8量体を形成し、これに約146塩基対のDNAが巻きつくことでヌクレオソームが構成されます。ヌクレオソーム間のDNAはリンカーDNAと呼ばれ、この部分に1分子のH1が結合します[11][14].
ヒストンの主要な機能と役割は、DNAをコンパクトに折りたたんで核内に収納することにあります。このプロセスにより、約2mにも及ぶ長いDNAが細胞核内に効率的に収納されます。また、ヒストンは遺伝子の発現調節にも重要な役割を果たしています。ヒストンのN末端側のアミノ酸配列(ヒストンテール)は、アセチル化、メチル化、リン酸化などの様々な化学修飾を受けることができ、これらの修飾はクロマチンの構造や遺伝子のアクセシビリティに影響を与えます。例えば、ヒストンがアセチル化されると、DNAとの相互作用が弱まり、遺伝子の転写が促進されます。逆に、ヒストンのメチル化は遺伝子の発現を抑制する場合が多いです[14][17].
ヒストンの化学修飾による遺伝子発現の調節は、エピジェネティクスの重要な機構の一つであり、細胞の分化や発達、疾病の発生に深く関わっています。ヒストン修飾のパターンは、遺伝子の塩基配列の変更を伴わずに遺伝子の機能を調節するため、エピジェネティック(遺伝子以外)な調節と呼ばれます。これらの修飾は、遺伝コードとは別の情報を持ち、ヒストンコードと呼ばれています[14].
8量体のヒストンに巻き付くDNAは146塩基で1.65回転しています。
ヒストンの種類と分類
ヒストンは、真核生物の細胞核に存在し、DNAをコンパクトに折りたたんでクロマチン構造を形成するためのタンパク質群です。ヒストンは主に5種類に分類され、それぞれが異なる特徴と役割を持っています[7][10].
● H1(リンカーヒストン)
– H1はリンカーヒストンと呼ばれ、ヌクレオソーム間のDNA(リンカーDNA)に結合します。
– H1はクロマチンの高次構造の形成に関与し、ヌクレオソームの密度を高めることでDNAのアクセスを制御します[7][10].
● H2A
– H2Aはコアヒストンの一つで、ヌクレオソームの構造に必要な8量体の一部を形成します。
– H2Aにはいくつかのバリアントが存在し、その中でもH2A.Zは遺伝子の転写活性領域と抑制領域の両方に集積し、遺伝子発現の制御に重要な役割を果たします[13][15].
● H2B
– H2Bもコアヒストンの一つで、H2Aとペアを形成してヌクレオソームの構造に寄与します。
– H2BのN末端テイルは、アセチル化やメチル化などの翻訳後修飾を受けることが知られており、これらの修飾は遺伝子の発現制御に関わります[1][2].
● H3
– H3はコアヒストンの中でも特に遺伝子発現の制御に関与する重要なタンパク質です。
– H3には複数のバリアントが存在し、例えばH3.3は細胞周期に依存せずに発現し、遺伝子の活性化に関与することが知られています[5][13].
● H4
– H4はコアヒストンの一つで、H3とペアを形成し、ヌクレオソームの構造の基本単位を形成します。
– H4のN末端テイルも翻訳後修飾を受け、これによってクロマチンの構造と機能が調節されます[1][2].
● 役割と機能
ヒストンは、DNAをコンパクトに収納する役割を持つだけでなく、その化学修飾によって遺伝子の発現をダイナミックに制御します。アセチル化、メチル化、リン酸化、ユビキチン化などの修飾は、クロマチンのアクセス性を変化させ、遺伝子のオン・オフを調節することで、細胞の分化、発生、細胞運命の維持などに重要な役割を果たしています[11][12].
ヒストンの修飾は、特定の遺伝子領域の転写を活性化または抑制することにより、細胞の機能と運命を決定します。例えば、ヒストンH3のリジン4のトリメチル化(H3K4me3)は転写活性化に関与し、リジン27のトリメチル化(H3K27me3)は転写抑制に関与することが知られています[12].
ヒストンバリアントは、特定の組織や細胞タイプで特異的に発現し、クロマチンの構造と機能に多様性をもたらします。これらのバリアントは、生殖細胞の形成やがんの発生など、生物学的プロセスにおいて特有の役割を果たすことが示されています[13][15].
- 参考文献・出典
-
[1] www.nsc.nagoya-cu.ac.jp/~jnakayam/_src/sc744/pubj03.pdf
[2] www.qst.go.jp/site/press/20210705.html
[11] www.abcam.co.jp/epigenetics/histone-modifications-ja
[12] www.yodosha.co.jp/jikkenigaku/keyword/835.html
[13] seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2022.940271/index.html
[15] waseda.repo.nii.ac.jp/record/58058/files/Honbun-8399.pdf
第2章: ヒストンの修飾とその影響
主要なヒストン修飾
ヒストンの化学的修飾は、遺伝子の発現調節において重要な役割を果たしています。主要な修飾にはアセチル化、メチル化、リン酸化、ユビキチン化などがありますが、ここでは特にアセチル化とメチル化に焦点を当てて説明します。
● ヒストンアセチル化
ヒストンアセチル化は、ヒストンのリジン残基にアセチル基が付加されることにより、ヒストンとDNA間の静電的結合が弱まり、クロマチン構造が開放されます。これにより、転写因子がDNAにアクセスしやすくなり、遺伝子の発現が促進されます[4][9]. アセチル化は、ヒストンアセチル化酵素(HAT)によって付加され、ヒストン脱アセチル化酵素(HDAC)によって除去されます[4][5]. このダイナミックなバランスが遺伝子の活性化と抑制を調節し、細胞の応答や発達過程において重要な役割を果たします。
● ヒストンメチル化
ヒストンメチル化は、リジンやアルギニン残基にメチル基が付加される修飾で、遺伝子の発現を促進する場合と抑制する場合があります。メチル化の位置とメチル基の数(モノメチル、ジメチル、トリメチル)によってその効果が異なります[9][10]. 例えば、ヒストンH3のリジン4位のトリメチル化(H3K4me3)は転写の活性化と関連していますが、ヒストンH3のリジン27位のトリメチル化(H3K27me3)は転写の抑制と関連しています[12].
ヒストンメチル化は、リジンメチル基転移酵素(KMT)によって付加され、リジン脱メチル化酵素(KDM)によって除去されます[10]. これらの酵素は、特定のリジン残基とメチル化の程度に対して特異性を持ち、クロマチンの構造と機能に深く影響を与えます。
● 生物学的意義
これらのヒストン修飾は、細胞の発達、分化、病態の調節において中心的な役割を果たします。例えば、異常なヒストン修飾パターンはがんを含む多くの疾患の発生に関与しています[6][12]. また、エピジェネティックな遺伝子発現制御は、環境因子に対する生物の適応機構としても機能します[2][7].
ヒストン修飾の研究は、これらの複雑な調節ネットワークを解明し、新たな治療標的の発見や疾患理解の深化に寄与しています。
- 参考文献・出典
-
[4] www.yodosha.co.jp/jikkenigaku/keyword/3778.html
[5] www.jstage.jst.go.jp/article/cra/20/2/20_157/_pdf/-char/ja
[6] www.cosmobio.co.jp/product/detail/product-epigene-20130618-2.asp?entry_id=11226
[7] www.secomzaidan.jp/ippan/interview/medical/ichiyanagi/inta1.html
[9] ruo.mbl.co.jp/bio/product/epigenome/article/histone-modification.html
[10] www.cellsignal.jp/pathways/chromatin-methylation-pathway
[12] www.yodosha.co.jp/jikkenigaku/keyword/835.html
ヒストン修飾が遺伝情報に与える影響
ヒストン修飾はエピジェネティクスの中心的なメカニズムの一つであり、遺伝子の発現を調節する重要な役割を果たしています。エピジェネティクスは、DNAの塩基配列に変化を加えることなく、遺伝子の機能を変化させる一連のプロセスを指します。ヒストン修飾は、遺伝子のオン・オフを切り替えることによって、細胞の特定の時期や状態に応じた遺伝子発現パターンを制御します。
● ヒストン修飾の種類とその機能
ヒストンはDNAを巻き付けるタンパク質で、そのN末端にあるヒストンテールは、アセチル化、メチル化、リン酸化、ユビキチン化などの多様な化学修飾を受けることができます。これらの修飾は、ヒストンとDNAの相互作用を変化させ、クロマチンの構造を変えることで遺伝子のアクセス性を調節します[1][2][3][4][7][8][9][10][11][12][13][14]。
– アセチル化: ヒストンのアセチル化は、ヒストンの正電荷を減少させ、DNAとの結合を緩めます。これにより、クロマチンが開放状態になり、転写因子がDNAにアクセスしやすくなり、遺伝子の発現が促進されます[7][9][10][11].
– メチル化: ヒストンのメチル化は、遺伝子の発現を促進する場合もあれば、抑制する場合もあります。メチル化の位置や程度(モノメチル化、ジメチル化、トリメチル化)によって、その効果は異なります。例えば、ヒストンH3のリジン4位のメチル化(H3K4me)は遺伝子の発現を促進することが知られていますが、ヒストンH3のリジン9位のメチル化(H3K9me)は遺伝子の発現を抑制することが多いです[1][2][3][4][7][8][9][10][11][12][13][14].
● エピジェネティクスと遺伝子発現の調節
ヒストン修飾は、遺伝子の発現を時間的、空間的に精密に制御するために不可欠です。細胞分化や発生過程で、特定の遺伝子が必要な時にのみ発現するように調節されます。また、環境因子や細胞の代謝状態に応じて、遺伝子発現のパターンが変化することもあります。このように、ヒストン修飾は細胞のアイデンティティを維持し、適応的な応答を可能にするためのエピジェネティックなメカニズムの一部です[1][2][3][4][7][8][9][10][11][12][13][14].
● 疾患との関連
ヒストン修飾の異常は、がんをはじめとする多くの疾患の発生に関連しています。例えば、がん抑制遺伝子のプロモーター領域のヒストンが過剰にメチル化されると、その遺伝子の発現が抑制され、がんの進行に寄与する可能性があります。このように、ヒストン修飾のパターンの変化は、疾患の診断や治療の新たな標的となる可能性を秘めています[7][9][10][11][12][13][14].
ヒストン修飾は、遺伝子の発現を調節するエピジェネティックなメカニズムの一つであり、細胞の機能と運命を決定する上で重要な役割を担っています。修飾の種類や組み合わせによって、遺伝子の発現が促進されたり抑制されたりすることで、細胞の特性が決定され、健康と疾患の状態が影響を受けます。
- 参考文献・出典
-
[1] www.dojindo.co.jp/letterj/166/review/01.html
[2] www.japanprize.jp/data/prize/2014/j_2_achievements.pdf
[3] www.jstage.jst.go.jp/article/tits/19/8/19_8_16/_pdf/-char/ja
[4] www.cosmobio.co.jp/product/detail/product-epigene-20130618-2.asp?entry_id=11226
[5] www.riken.jp/press/2022/20220621_1/index.html
[6] kimura-lab.bio.titech.ac.jp/research.html
[7] ruo.mbl.co.jp/bio/product/epigenome/article/histone-modification.html
[8] bsd.neuroinf.jp/wiki/%E3%83%92%E3%82%B9%E3%83%88%E3%83%B3
[9] www.abcam.co.jp/epigenetics/histone-modifications-ja
[10] www.nies.go.jp/kanko/kankyogi/59/column2.html
[11] diagenode.co.jp/histone-modification/what-is-epigenetics
[12] www.mm.rcast.u-tokyo.ac.jp/research/research_02.html
[13] www.jstage.jst.go.jp/article/jjsci/53/8/53_05/_pdf/-char/en
[14] www.secomzaidan.jp/ippan/interview/medical/ichiyanagi/inta1.html
第3章: ヒストンと疾患
ヒストン修飾の異常と疾患発生
ヒストン修飾の異常は、がんや先天異常疾患、自閉症スペクトラム、生活習慣病など多くの疾患の発生に重要な役割を果たしています。ヒストン修飾とは、ヒストンタンパク質に対する化学的修飾(メチル化、アセチル化、リン酸化など)のことで、これらの修飾は遺伝子の発現を調節し、細胞の機能や運命を決定する重要な役割を担っています。以下に、ヒストン修飾の異常と疾患発生の関連性について、具体的な症例を交えて説明します。
● がん
ヒストン修飾の異常は、がん細胞の遺伝子発現パターンを変化させ、がんの発生や進行に関与します。例えば、東京医科歯科大学の研究では、胃がんにおいてヒストン修飾に関わるPRMT6が活性化し、がん抑制遺伝子のPCDH7が不活化していることが明らかにされました[12][13]。このようなヒストン修飾の異常により、がん抑制遺伝子が沈黙し、がん細胞の悪性度が増すメカニズムが示唆されています。
● 先天異常疾患
ヒストン修飾異常は、多臓器にわたる先天異常疾患や自閉症スペクトラムをもたらすことがあります。ヒストン修飾、クロマチンリモデリング異常は、発生過程での遺伝子発現の誤調節を引き起こし、先天異常の原因となることが示されています[11]。
● 自閉症
理化学研究所の研究では、ヒストンメチル化の異常が自閉症に関連するメカニズムを発見しました[3]。ヒストンメチル化は遺伝子の発現を調節する重要なエピジェネティックなメカニズムであり、その異常が自閉症の発症に関与している可能性があります。
● 生活習慣病
ヒストン修飾の異常は、生活習慣病の発生にも関わっています。例えば、エピジェネティクスと癌に関する研究では、DNAメチル化とヒストン修飾異常が癌の発症メカニズムを新規の観点から理解できる可能性があるとされています[2]。
● リウマチ性疾患
ヒストン修飾の解析により、リウマチ性疾患におけるヒストン修飾の変化が疾患活動性と関連していることが示されています[14]。これは、エピジェノム異常が病態に関与している可能性を示唆しています。
これらの研究結果は、ヒストン修飾の異常が疾患の発生に深く関わっていることを示しており、エピジェネティクスの研究は疾患の診断や治療の新たなアプローチを提供する可能性を秘めています。ヒストン修飾異常による疾患の発生メカニズムの解明は、将来的に疾患の予防や治療において重要な役割を果たすことが期待されます[1][2][3][4][5][6][7][8][9][10][11][12][13][14].
- 参考文献・出典
-
[1] www.jstage.jst.go.jp/article/jjsth/32/5/32_2021_JJTH_32_5_619-624/_html/-char/ja
[2] www.jstage.jst.go.jp/article/medchem/21/4/21_18/_pdf/-char/ja
[3] www.riken.jp/press/2021/20210715_2/index.html
[4] www.ncc.go.jp/jp/ri/division/molecular_modification_and_cancer_biology/project/010/20170908154407.html
[5] www.jstage.jst.go.jp/article/tits/19/8/19_8_16/_pdf/-char/ja
[6] www.u-tokyo.ac.jp/focus/ja/press/z0111_00035.html
[7] www.abcam.co.jp/epigenetics/histone-modifications-ja
[8] www.nies.go.jp/kanko/kankyogi/59/column2.html
[9] bukai.pharm.or.jp/bukai_kanei/topics/topics67.html
[10] www.jstage.jst.go.jp/article/jscc1971b/36/4/36_288/_pdf/-char/ja
[11] kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-20K08270/
[12] www.qlifepro.com/news/20181206/gastric-cancer-increases-malignancy-due-to-abnormal-histone-modification.html
[13] www.tmd.ac.jp/archive-tmdu/kouhou/20181204_2.pdf
[14] www.saitama-med.ac.jp/jsms/vol44/02/jsms44_087_089.pdf
がんとヒストン修飾
ヒストン修飾は、遺伝子の発現を調節する重要なエピジェネティックなメカニズムの一つです。ヒストンタンパク質はDNAを巻きつけることでクロマチンを形成し、その構造の変化によって遺伝子のアクセスが制御されます。ヒストン修飾には、メチル化、アセチル化、リン酸化などがあり、これらの化学的変更が遺伝子の活性化または抑制に寄与します[1][2][3][4][5].
♦ がん発生におけるヒストン修飾の役割
がん細胞では、ヒストン修飾パターンが異常を来たすことが多く、これが遺伝子発現の異常につながり、細胞の増殖、分化の失敗、アポトーシスの回避など、がんの特徴的な振る舞いを引き起こします。例えば、ヒストンのメチル化異常は、がん抑制遺伝子の不活性化やオンコジーンの過剰発現に関与しています[1][2][3].
♦ 最近の研究動向
● ヒストン修飾の異常とがんの進行
最近の研究では、特定のヒストン修飾異常が特定のがんの発生や進行と密接に関連していることが明らかにされています。例えば、ヒストンメチル化酵素の異常は、リンパ腫や固形腫瘍など多くのがんタイプで観察され、これらの酵素を標的とした治療が開発されています[1][2][6].
● ヒストン修飾を標的とした治療戦略
ヒストン修飾酵素に対する阻害剤の開発が進んでおり、これによりがん細胞の成長を抑制する新たな治療法が期待されています。例えば、ヒストンデアセチラーゼ(HDAC)阻害剤は、すでにいくつかのがんタイプで臨床試験が行われており、一部は効果を示しています[1][2][3][4].
● エピジェネティックな変化の診断としての利用
ヒストン修飾のパターンは、がんの診断や予後の指標としても有用である可能性があります。特定のヒストン修飾の異常が、がんの種類や進行度を反映するバイオマーカーとして機能することが研究されています[1][2][5].
♦ 結論
ヒストン修飾はがんの発生と進行において重要な役割を果たしており、これを標的とした治療法の開発が進められています。また、ヒストン修飾の異常を利用した新たな診断方法の開発も期待されています。これらの進展は、がん治療の新たな道を開く可能性を秘めています。
- 参考文献・出典
-
[1] genomebiology.biomedcentral.com/articles/10.1186/s13059-019-1870-5
[2] www.nature.com/articles/6603844
[3] www.ncbi.nlm.nih.gov/pmc/articles/PMC5834259/
[4] www.mdpi.com/journal/cancers/special_issues/histone_collection
[5] www.ncbi.nlm.nih.gov/pmc/articles/PMC4817802/
[6] www.mdpi.com/1422-0067/24/5/4939
第4章: ヒストン研究の最前線
ヒストン研究の進化と進行中の研究
ヒストンは、DNAをコンパクトに折りたたんでクロマチンを形成し、遺伝子の発現を調節するための基本的なタンパク質です。最近の研究では、ヒストンの変異やその修飾が遺伝子の発現に与える影響が明らかにされつつあります。ここでは、ヒストンに関する最新の研究成果と今後の展望について概説します。
● 最新の研究成果
1. ヒストン変異の機能とメカニズム
– ヒストンのバリアントは、植物の成長、発達、ストレス応答において重要な役割を果たしています。特に、H2A.ZとH3K4me3の相互作用がアントシアニン生合成のエピジェネティックな調節に関与していることが示されています[8]。
2. ヒストン修飾の進化
– ヒストンのメチル化修飾は、植物王国全体での進化を追跡する研究が行われており、大麦の適応や成長の調節に関与していることが示されています[1]。
3. ヒストン修飾の技術革新
– シングルセル解析技術の進展により、ヒストン修飾と遺伝子発現を同時にマッピングする新しい方法が開発されています。これにより、細胞レベルでのエピジェネティックな変化を詳細に理解することが可能になります[19]。
● 今後の展望
1. 疾患治療への応用
– ヒストン修飾の異常は多くの疾患の発症に関与しているため、これらの修飾を標的とした新しい治療法の開発が進められています。特に、がんや神経変性疾患におけるヒストン修飾酵素の阻害剤が臨床試験において評価されています[12]。
2. エピジェネティックな記憶の解明
– ヒストン修飾は細胞の記憶にも関与しており、特定の環境条件下での遺伝子発現パターンの変化を記憶するメカニズムの解明が進んでいます。この研究は、進化生物学だけでなく、発生生物学や疾患モデルにおいても重要な意味を持ちます[16]。
3. 新しいヒストン修飾の発見
– 最新の質量分析技術の進歩により、未知のヒストン修飾の同定が進んでいます。これらの新しい修飾の機能解析は、遺伝子の発現調節における新たなメカニズムを明らかにする可能性を秘めています[17][18]。
● 結論
ヒストンとその修飾は、遺伝子の発現を調節する上で中心的な役割を果たしています。最新の研究により、これらのプロセスがどのように進化し、様々な生物学的プロセスにどのように関与しているかの理解が深まっています。今後もヒストンに関する研究は、基礎生物学だけでなく、医学的な応用においても重要な進展を遂げることが期待されます。
- 参考文献・出典
-
[8] www.frontiersin.org/journals/genetics/articles/10.3389/fgene.2023.1229782/full
[11] www.nature.com/articles/cr201142
[12] clinicalepigeneticsjournal.biomedcentral.com/articles/10.1186/s13148-023-01562-1
[16] genomebiology.biomedcentral.com/articles/10.1186/gb-2010-11-2-105
[17] newsroom.ucla.edu/releases/study-pinpoints-new-function-for-histones
[18] www.ncbi.nlm.nih.gov/pmc/articles/PMC9764139/
[19] www.nature.com/subjects/histone-analysis
[20] www.pnas.org/doi/full/10.1073/pnas.2007056117
ヒストン研究の応用
ヒストン研究は、遺伝子の発現調節、細胞周期の制御、発生生物学、疾患の発生メカニズムの理解など、多岐にわたる科学分野に応用されています。ヒストンのポストトランスレーショナル修飾(PTM)は、クロマチンの構造と機能に深く関わっており、これらの修飾の研究は、細胞の遺伝的情報の読み出し方に影響を与えることが示されています[1][2][3][4][5][6][7][8]。
● 発生生物学と疾患の研究
– 発生生物学: ヒストン修飾は細胞分化と発生過程において重要な役割を果たしています。例えば、H3K27のメチル化は、胚性幹細胞の多能性と分化を調節することが知られており、この修飾の研究は幹細胞の運命決定や組織形成のメカニズムを解明するのに役立っています[4]。
– がん研究: ヒストン修飾の異常は、がんを含む多くの疾患の発生に関連しています。ヒストン変異や異常なPTMパターンは、遺伝子の不適切な発現を引き起こし、細胞の異常な増殖や生存に寄与することが示されています。このため、ヒストン修飾の研究は、がんの診断や治療の新たな標的を見つけるための基礎となっています[4]。
● エピジェネティクスと遺伝子発現
– エピジェネティクス: ヒストン修飾はエピジェネティックな情報を担い、細胞記憶や遺伝子のオン・オフを制御することで、遺伝子発現のパターンを調節します。この分野の研究は、遺伝子の発現調節メカニズムの理解を深めるだけでなく、エピジェネティックな変化がどのようにして疾患のリスクに影響を与えるかを明らかにすることにも寄与しています[1][2][3]。
● テクノロジーと方法論の進歩
– 質量分析法: ヒストンPTMの研究において、質量分析(MS)ベースのアプローチは、クロマチンの調節における未探索のヒストンPTM機能を解明するための強力なツールとなっています。これにより、ヒストン修飾のグローバルなランドスケープを特徴づけ、非モデル生物の組織内でのヒストンPTMを研究する新しい戦略が開発されています[5][6][7]。
– イメージング法: ヒストンの継承を研究するためのイメージングベースの方法は、単一細胞解像度でヒストン継承パターンを視覚化する能力を持ち、遺伝子配列情報と組み合わせることで、生体内でのヒストン継承をシングルセル解像度で研究するための将来の技術開発が必要とされています[2]。
– ヒストン置換: ヒストン置換システムは、ヒストン変異体間の微妙な配列差異の役割を研究するための理想的なツールとして機能し、これによりヒストンの機能を直接評価することが可能になります[8]。
これらの応用は、ヒストン研究が生命科学の多くの分野において中心的な役割を果たしていることを示しています。ヒストンのダイナミクスと修飾の理解は、細胞の機能と疾患のメカニズムを解明するための基盤となり、新しい治療法や診断法の開発につながる可能性があります。
- 参考文献・出典
-
[1] www.frontiersin.org/articles/10.3389/fcell.2020.00701/full
[2] www.ncbi.nlm.nih.gov/pmc/articles/PMC10317187/
[3] www.ncbi.nlm.nih.gov/pmc/articles/PMC4216925/
[4] www.asbmb.org/asbmb-today/science/032324/histone-modifications-in-development-and-disease
[5] www.sciencedirect.com/science/article/pii/S1535947620351203
[6] pubs.acs.org/doi/10.1021/acs.jproteome.3c00246
[7] www.mcponline.org/article/S1535-9476%2820%2935120-3/pdf
[8] www.cell.com/trends/biochemical-sciences/fulltext/S0968-0004%2822%2900164-5?rss=yes






